- 251.00 KB
- 63页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'雌激素一、甾体雌激素结构类型:雌甾烷类母体结构:雌甾烯醇特点:苯环(A环)雌甾-1,3,5(10)三烯-3-醇OH1351061
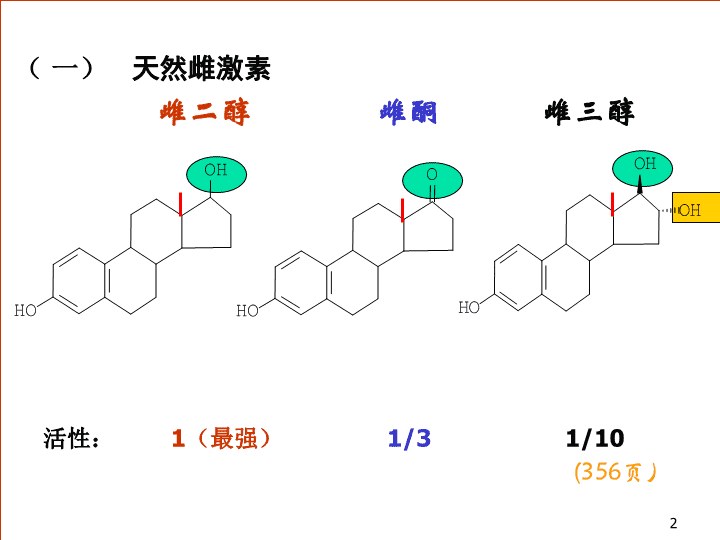
(一)天然雌激素雌二醇雌酮雌三醇活性:1(最强)1/31/10(356页)2
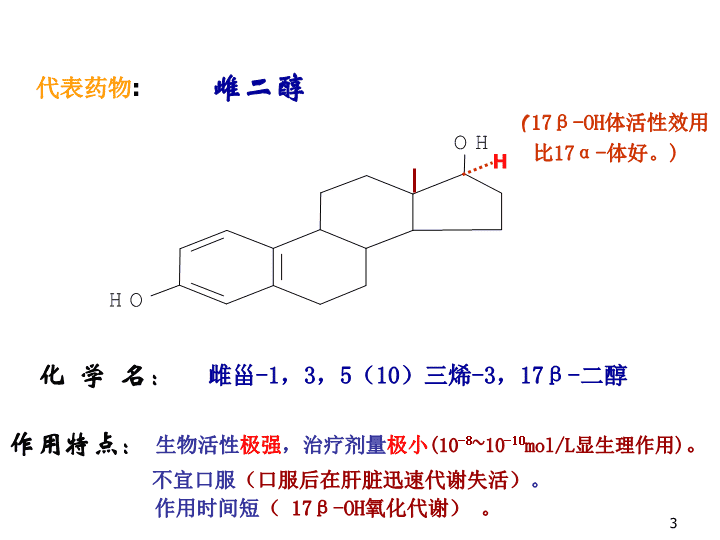
代表药物:雌二醇(17β-OH体活性效用比17α-体好。)化学名:雌甾-1,3,5(10)三烯-3,17β-二醇作用特点:生物活性极强,治疗剂量极小(10-8~10-10mol/L显生理作用)。不宜口服(口服后在肝脏迅速代谢失活)。作用时间短(17β-OH氧化代谢)。H3
(二)合成雌激素雌二醇的活性已相当高,因而在化学机构修饰时研究的问题已不是药效,而是希望获得使用方便、药效持久、作用专一的药物。结构改造目的:寻找口服、长效、副作用少的雌激素。发现具有其它作用的新药。1.半合成品(1)口服强效类(17α–乙炔)乙炔雌醇367页17β-OH17叔羟,其氧化、硫酸酯化代谢(失活)受阻。(357页)4
化学名:17α-乙炔基-雌甾-1,3,5(10)三烯-3,17β-二醇(又名:乙炔雌二醇)作用特点:强效(是雌二醇的15-20倍!)、长效(可维持一月以上)。可口服(17β-羟基代谢受阻。356页)。结构改造:3位-醚化长效例如:乙炔雌二醇-3-环戊醚(炔雌醚)(CH3)长效雌激素的特殊结构(其余基团无延效作用)(¼效)5
(2)长效类①3位-醚化(炔雌醚)②3位-酯化、17β位-酯化例如:苯甲酸雌二醇环戊丙酸雌二醇OOHO当其肌注给药时,其作用可持续4周之久。最早使用的雌激素前体6
半合成甾体雌激素的结构通式:强效(R)可口服的雌激素类药物长效(R1、R2)的雌激素类药物OHCH3R2RR1O0.8551.450.388参见:356页7
(三)、构效关系1、雌激素的结构专属性不高,不少没有完整甾体的化合物以及一些植物成分也有雌激素活性。但要具备能与雌激素受体结合的立体结构要求:分子的两个能与受体形成氢键的基团(如酮、酚、醇羟基),其间相距1.45nm、0.855nm,分子宽度为0.388nm,X-光结晶学证明了这个距离。(360页:顺式己烯雌酚仅0.72约为14.5/2)2、甾体雌激素基本结构是:雌甾核(C10无角甲基)、A环为苯环、C3、C17含氧功能基(其与雌激素有很强的亲和力)。3、17-羟基β-构型(比α-构型)的活性高。17α位引入乙炔基或甲基,增效且可口服。(仲羟变叔羟,代谢受阻)。4、酯类、醚类有延效作用。(口服可储存在脂肪中、并缓慢释放出活性物)8
二、非甾类雌激素1、反式二苯乙烯类雌激素与其它甾体激素不同,甾核对于雌激素活性不是必需的,加之从天然植物资源中未发现有A环芳香化的甾体来源,合成又非常复杂,因此促使人们寻找结构简化、制备方便的合成代用品。在新药开发过程中经筛选,至少发现有30类以上、1000种非甾体化合物显示有雌激素活性。其中己烯雌酚,活性较强。代表药物:己烯雌酚反式有效(1.45nm)顺式无效(0.72nm)9
2、雌激素拮抗剂主要类型:三苯乙烯类作用:具有明显的抗雌激素活性,仅有很弱的雌激素活性。用途:用于治疗不育症和乳腺癌。代表药物:他莫昔芬(361页)结构特点:具有二苯乙烯的基本结构该结构的C2位引入了大体积的苯环,产生立体障碍。作用机制:在靶细胞中竞争性阻断雌激素与受体的结合,从而表现抗雌激素活性。类似己烯雌酚的反式结构10
雄雄激素、蛋白同化激素一、雄激素用途:用于内源性激素分泌不足的补充疗法。结构类型:雄甾烷类母体结构:17β-羟基-雄甾--4-烯-3-酮11
(一)天然雄激素1.1931年,科学家Butenandt从15吨男性尿中分离出15毫克雄素酮,(但其效力太弱,无实用价值。)1935年,又从雄仔牛的睾丸中提取到作用较强的内源性激素:睾丸素(睾酮)H酯化——长效甲基化——口服12
特点:天然中活性最强,但短效、口服(几乎不吸收)无效。为了寻找口服有效、长效、高效、副作用小的药物,对睾丸素进行了一系列的改造。(二)合成雄激素、同化激素1、合成雄激素(1)、17β-OH酯化:脂溶性增强,使代谢缓慢而延效。代表药:丙酸睾酮前药13
丙酸睾酮注射一次延效2~4天环戊丙酸睾酮注射一次维持一个月以上(366页)(2)17α位引入甲基,增加位阻,使17β仲醇羟基变为叔羟基,不易被代谢氧化失活,稳定性增加,可口服。例1:甲睾酮(甲基睾丸素)17α-甲基-17β-羟基-雄甾--4-烯-3-酮OOHCH314
-17α-引入乙炔基,呈现出孕激素活性,而雄激素活性显著减弱。例2:乙炔睾丸素(妊娠素)发现:1.19去甲-雄甾类孕激素、2.蛋白同化激素。(3)A环部分改变,得到了一类较好的蛋白同化激素(364~365页)。2位取代,19-去甲等,尤其是将A环并一五员环,均明显降低了雄激素的作用而增加了蛋白同化作用,(365页)雄H活性孕激素活性了A环改变蛋白同化活性并环或引入取代基15
雄激素构效关系1.A环变动蛋白同化活性增强、雄性活性降低——蛋白同化激素的发现2.17β-OH成酯,代谢延缓,缓释——长效药物的发现3.17α-烃基取代:(1)17α-甲基不易在肝脏内被破坏、口服吸收快——口服药物的发现(2)17α-乙炔基,19-去甲具孕激素活性;降低雄性活性——19-去甲睾酮类孕激素16
孕激素一、天然孕激素代表药物:黄体酮结构类型:孕甾烷类化学名:孕甾-4-烯-3,20-二酮(与雄甾激素相比仅17位取代基不同)作用特点:活性强、短效、口服无效(肝内代谢失活)。368页(只能制成油剂供注射使用)OH睾丸素孕、雄激素相同部分雄甾-4烯-3-酮17
二、合成孕激素(一)19-去甲睾酮类孕激素(17α-孕酮类)经典孕甾是17β-位侧链,而这类孕甾为17α-侧链。代表药物:炔诺酮(367页)化学名:17β-羟基-19-去甲-17α-孕甾-4-烯-20-炔-3-酮18
6-(二)孕酮类孕激素1.长效类——17α-酯类(低口服活性)代表药:己酸孕酮(17α-己酰氧基-黄体酮)367页注射一次/月(口服活性低:妊娠素的1/2,炔诺酮的1/100)2.强效口服类——17α-酯类及B环的取代在B环的6α-引入双键、卤素或甲基,都使口服作用增强数十倍(368~369页)。药物活性乙酸孕酮(17α-乙酸孕酮)1/100炔诺酮6α-甲基-乙酸孕酮(醋酸甲羟孕酮)20倍炔诺酮6α-氯-6-烯乙酸孕酮(醋酸氯地孕酮)50倍炔诺酮19
例如:醋酸甲地孕酮、、药物特点:口服为黄体酮的75倍,注射为其50倍!强效、长效20
(三).构效关系:1、孕激素结构专属性高,稍加改变作用即发生显著变化。例如:17α-羟基黄体酮无效17α-成酯长效、具口服活性2、B环改动(6位引入双键、氯或甲基),能显著增效,有口服特性。例如:6-烯(6α-甲基)强效6-烯-6-Cl超强效3.17α-引入酯基,可延效。乙酸17α-羟基黄体酮+己酸长效孕激素环戊丙酸(口服无效)21
三、孕激素拮抗剂孕激素拮抗剂——与孕激素竟争受体并拮抗其活性的化合物,也称抗孕激素。(是终止早孕的重要药物。)代表药物:米非司酮(372页)。结构类型:19-去甲-17α-孕甾(与炔诺酮相同)(以炔诺酮为先导化合物,经结构修饰获得的抗作用药。)拮抗基团:11β-对二甲氨苯基、药动团:9(10)-烯(参见:374页;对照:367页炔诺酮的结构)炔诺酮22
世界人口增长概况年代世界人口中国人口1000年6000万左右1600万左右1807年10亿1927年20亿1974年40亿9亿1987年50亿12亿1999年60亿2000.712.78亿23
四、避孕药本世纪50年代末,出现了口服甾类避孕药,它的创制是人类控制生育的重大突破。服甾类避孕药优于其它避孕方法,成功率约为99.6%,副作用低,安全性高。(一)短效口服避孕药药品名孕激素(mg)雌激素(mg)复方炔诺酮片(避孕片1号)炔诺酮0.625炔雌醇0.0335复方甲地孕酮片(避孕片2号)甲地孕酮1.0炔雌醇0.0335复方炔诺孕酮片(复甲一号)炔诺孕酮0.3炔雌醇0.0324
(二)、长效避孕药药品名孕激素(mg)雌激素(mg)复方甲地氯孕酮片氯地孕酮0.625炔雌醚3复方炔诺孕酮片(复甲二号)炔诺孕酮12炔雌醚3己酸孕酮(避孕一号)己酸孕酮250戊酸雌二醇5长效避孕药中的前药比较多。25
肾上腺皮质激素(皮质激素)一.概述1.来源:髓质分泌:儿茶酚胺,肾上腺皮质合成:肾上腺皮质激素2.分类(按生理作用特点分类)盐皮质激素:主要影响水盐代谢和维持电解质平衡。本身的临床用途不确切,其代谢拮抗物作为利尿剂。糖皮质激素:主要与糖、脂肪、蛋白质代谢和生长发育等有密切关系,是一类重要药物,它们或多或少还保留有影响水、盐代谢作用,使钠离子从体内排出困难发生水肿,此为其副反应。26
3.糖皮质激素临床用途具有极广泛的、效果非常明显的临床用途:①替代疗法:治疗急性或慢性肾上腺皮质功能减退症。②严重急性感染、非典③休克④自身免疫性疾病和过敏性疾病⑤防止炎症及瘢痕⑥血液病或某些皮肤病重点内容:糖皮质激素27
二.糖皮质激素从肾上腺提出物中,分离得到47个化合物。其中具有高活性的代表化合物有:氢化可的松皮质酮黄体酮糖羟基三羟基黄体酮二羟基黄体酮28
基本母核:孕甾烷(结构类型)母体结构:孕甾烯-二酮-醇羟基黄体酮2129
(一)天然糖皮质激素天然糖皮质激素中抗炎活性最强的是氢化可的松。代表药物:氢化可的松化学名:11β,17α,21-三羟基孕甾-4-烯-3,20-二酮30
结构特征:三羟基黄体酮作用特点:抗炎、抗过敏、抗休克、抗毒素等,是天然皮质激素中药理作用最强的活性成分。不良反应:长期使用易产生不良反应,如:水盐代谢紊乱(主要)、诱发和加重感染或使体内潜在的病灶扩散(抗炎不抗菌,降低机体防御功能的原因)、诱发精神症状等(故临床使用时普遍比较谨慎)结构改造目的:主要集中在如何将糖、盐两种活性分开,以减少副作用。31
(二)合成糖皮质激素(氢化可的松的结构修饰和构效关系)1、C-21-羟基成酯——前药只有C-21为羟基能酯化。(可改善其生物利用度,而不改变其生物活性。)代表药:醋酸氢化可的松(379页)特点:①它的作用时间延长、稳定性增加。②为改变此类药物疏水性强、水中溶解度小的缺点,利用C-21羟基制备其铵盐、琥珀酸脂钠盐或磷酸脂钠盐,便于制成水溶液供注射用。32
2.C-1位的修饰(1)1,2位脱氢(A环引入双键)——抗炎活性增大4倍,钠储留作用不增加。(A环构型从半椅式变成船式,使A环变形,加强了与受体的亲和力)。A环引入双键是一种成功的手段,后来发展的有效皮质激素分子中A环均带双键(379页)。例如:醋酸氢化泼尼松、增效部位33
3、C-9位的修饰引入9α-氟原子,抗炎作用明显增强,但盐代谢作用增加更大。(抗炎作用增加11倍,钠储留增加300~800倍)(故9α-氟代氢化可的松只可外用。)34
4、C-6位的修饰在C-6位引入F原子可阻滞C-6氧化失活.且活性显著增强。如:6α-氟代氢可的抗炎活性比氢可增大10倍6α-氟代氢泼的抗炎活性比氢泼增大20倍醋酸氟轻松(9α-氟-6α-氟-衍生物)抗炎及钠储留活性均大副增加,而后者增加更多,因而只能外用(皮肤抗过敏药)。重要意义:①发现高活性基团——α-氟。在甾体激素中引入氟原子,已成为获得强效糖皮质激素类药物的最重要手段。(单纯的9α-氟原子副作用太大)。②发现去毒基团——C-16位引入羟基或甲基(可抵消钠储留增加部分。)35
5、C-16位的修饰在C-9α位引入-氟原子的同时,再在C-16位上引入羟基(甲基),可消除-9α-氟所致钠储留作用。如:地塞米松C-16位甲基的存在可增加稳定性(17α-羟、C-20-羰在血浆中的稳定性)抗炎活性比氢可大20倍、抗风湿活性比氢可大30倍。去毒副36
将地塞米松16α-甲基转换为16β-甲基得:倍他米松抗炎作用较16α-甲基强2~3倍。37
甾体激素小结、重点一.结构通式甾体雌激素(357页)氢化可的松类(379页)孕甾类孕激素(367页)二.代表药物1.天然类药物:半合成类:2.合成类全合成类:三.构效关系1.糖皮质激素(381页)2.孕激素(369页)3.蛋白同化激素(364页)雌二醇、黄体酮睾酮、氢化可的松炔雌醇、甲睾酮、炔诺酮、地塞米松、苯丙酸诺龙己烯雌酚、他莫昔酚(口服、长效、强效、去毒等)。38
激素、小结、例题四.分类掌握甾体激素的药理分类、化学结构分类。掌握甾体激素药物的结构特征。(碳核类型、母体类型及结构特点)39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63'
您可能关注的文档
- 2019年洛阳第一批普通干线公路路网结构改造安防工程项目
- TY201005A25高层结构改造加固
- 某石化厂主管廊钢结构改造设计
- 喜树碱结构改造的研究进展
- 石杉碱甲结构改造的研究进展
- 我国商业银行收入结构改造
- 结构改造加固工程合同书(样本)
- 2013年公路路网结构改造工程(地质灾害)安全实施细则
- 组织结构改造方案的评估与建议
- 结构改造加固施工组织设计方案
- 建筑结构改造加固安全性检测鉴定模板
- 建筑结构改造加固安全性检测鉴定模板
- 建筑结构改造加固安全性检测鉴定模板
- GBT51087-2015 船厂既有水工构筑物结构改造和加固设计规范(完整)
- 房屋结构改造维修方面案例:
- 结构改造加固工程施工设计方案
- 炼铁厂高炉主卷扬室结构改造安全施工方案
- 2019年公路路网结构改造工程(地质灾害)监理计划