- 267.00 KB
- 7页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
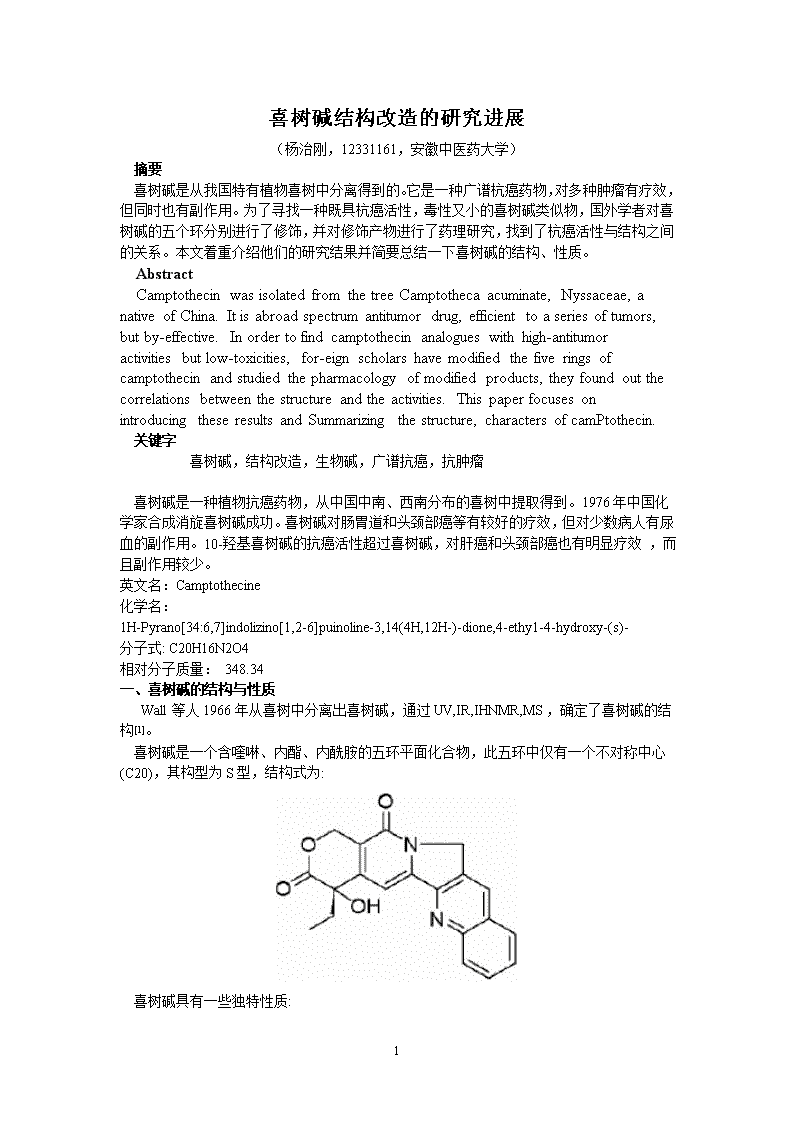
'喜树碱结构改造的研究进展(杨治刚,12331161,安徽中医药大学)摘要喜树碱是从我国特有植物喜树中分离得到的。它是一种广谱杭癌药物,对多种肿瘤有疗效,但同时也有副作用。为了寻找一种既具杭癌活性,毒性又小的喜树碱类似物,国外学者对喜树碱的五个环分别进行了修饰,并对修饰产物进行了药理研究,找到了杭癌活性与结构之间的关系。本文着重介绍他们的研究结果并简要总结一下喜树碱的结构、性质。AbstractCamptothecinwasisolatedfromthetreeCamptothecaacuminate,Nyssaceae,anativeofChina.Itisabroadspectrumantitumordrug,efficienttoaseriesoftumors,butby-effective.Inordertofindcamptothecinanalogueswithhigh-antitumoractivitiesbutlow-toxicities,for-eignscholarshavemodifiedthefiveringsofcamptothecinandstudiedthepharmacologyofmodifiedproducts,theyfoundoutthecorrelationsbetweenthestructureandtheactivities.ThispaperfocusesonintroducingtheseresultsandSummarizingthestructure,charactersofcamPtothecin.关键字喜树碱,结构改造,生物碱,广谱抗癌,抗肿瘤喜树碱是一种植物抗癌药物,从中国中南、西南分布的喜树中提取得到。1976年中国化学家合成消旋喜树碱成功。喜树碱对肠胃道和头颈部癌等有较好的疗效,但对少数病人有尿血的副作用。10-羟基喜树碱的抗癌活性超过喜树碱,对肝癌和头颈部癌也有明显疗效,而且副作用较少。英文名:Camptothecine化学名:1H-Pyrano[34:6,7]indolizino[1,2-6]puinoline-3,14(4H,12H-)-dione,4-ethy1-4-hydroxy-(s)-分子式:C20H16N2O4相对分子质量:348.34一、喜树碱的结构与性质Wall等人1966年从喜树中分离出喜树碱,通过UV,IR,IHNMR,MS,确定了喜树碱的结构[1]。喜树碱是一个含喹啉、内酯、内酰胺的五环平面化合物,此五环中仅有一个不对称中心(C20),其构型为S型,结构式为:喜树碱具有一些独特性质:7
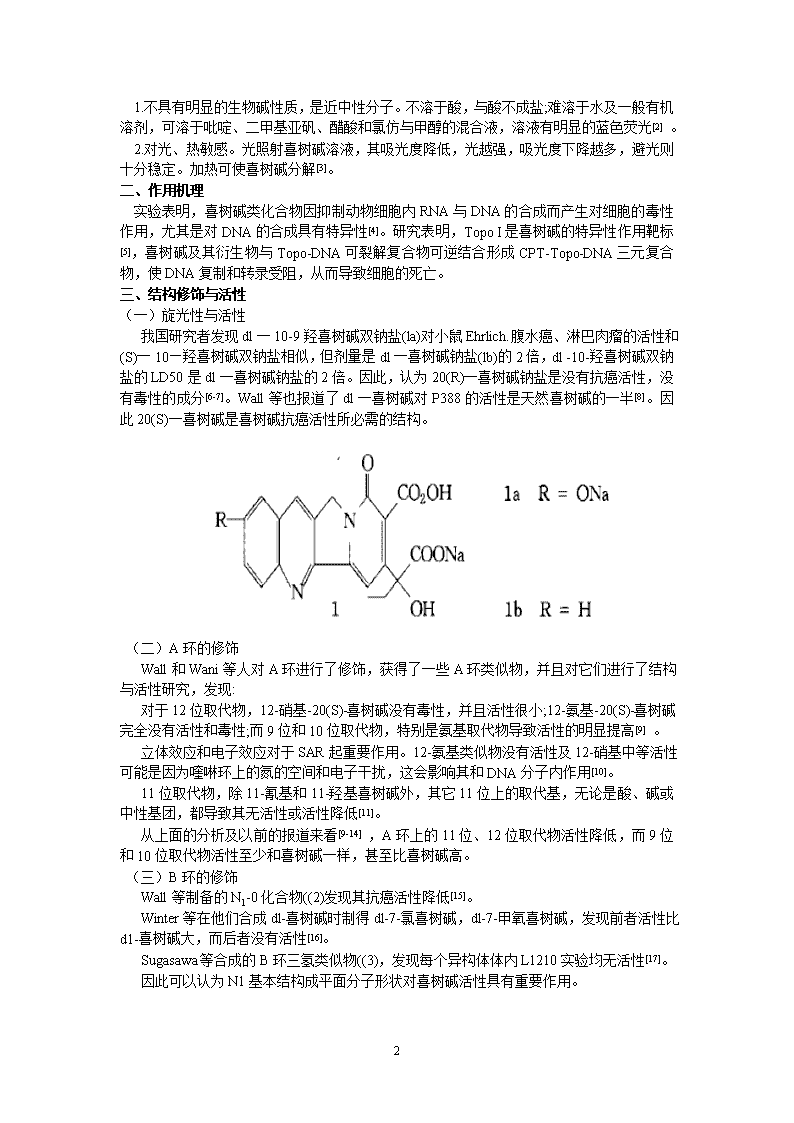
1.不具有明显的生物碱性质,是近中性分子。不溶于酸,与酸不成盐;难溶于水及一般有机溶剂,可溶于吡啶、二甲基亚矾、醋酸和氯仿与甲醇的混合液,溶液有明显的蓝色荧光[2]。2.对光、热敏感。光照射喜树碱溶液,其吸光度降低,光越强,吸光度下降越多,避光则十分稳定。加热可使喜树碱分解[3]。二、作用机理实验表明,喜树碱类化合物因抑制动物细胞内RNA与DNA的合成而产生对细胞的毒性作用,尤其是对DNA的合成具有特异性[4]。研究表明,TopoI是喜树碱的特异性作用靶标[5],喜树碱及其衍生物与Topo-DNA可裂解复合物可逆结合形成CPT-Topo-DNA三元复合物,使DNA复制和转录受阻,从而导致细胞的死亡。三、结构修饰与活性(一)旋光性与活性我国研究者发现dl一10-9羟喜树碱双钠盐(la)对小鼠Ehrlich.腹水癌、淋巴肉瘤的活性和(S)一10—羟喜树碱双钠盐相似,但剂量是dl一喜树碱钠盐(lb)的2倍,dl-10-羟喜树碱双钠盐的LD50是dl一喜树碱钠盐的2倍。因此,认为20(R)一喜树碱钠盐是没有抗癌活性,没有毒性的成分[6-7]。Wall等也报道了dl一喜树碱对P388的活性是天然喜树碱的一半[8]。因此20(S)一喜树碱是喜树碱抗癌活性所必需的结构。(二)A环的修饰Wall和Wani等人对A环进行了修饰,获得了一些A环类似物,并且对它们进行了结构与活性研究,发现:对于12位取代物,12-硝基-20(S)-喜树碱没有毒性,并且活性很小;12-氨基-20(S)-喜树碱完全没有活性和毒性;而9位和10位取代物,特别是氨基取代物导致活性的明显提高[9]。立体效应和电子效应对于SAR起重要作用。12-氨基类似物没有活性及12-硝基中等活性可能是因为喹啉环上的氮的空间和电子干扰,这会影响其和DNA分子内作用[10]。11位取代物,除11-氰基和11-羟基喜树碱外,其它11位上的取代基,无论是酸、碱或中性基团,都导致其无活性或活性降低[11]。从上面的分析及以前的报道来看[9-14],A环上的11位、12位取代物活性降低,而9位和10位取代物活性至少和喜树碱一样,甚至比喜树碱高。(三)B环的修饰Wall等制备的N1-0化合物((2)发现其抗癌活性降低[15]。Winter等在他们合成dl-喜树碱时制得dl-7-氯喜树碱,dl-7-甲氧喜树碱,发现前者活性比d1-喜树碱大,而后者没有活性[16]。Sugasawa等合成的B环三氢类似物((3),发现每个异构体体内L1210实验均无活性[17]。因此可以认为N1基本结构成平面分子形状对喜树碱活性具有重要作用。7
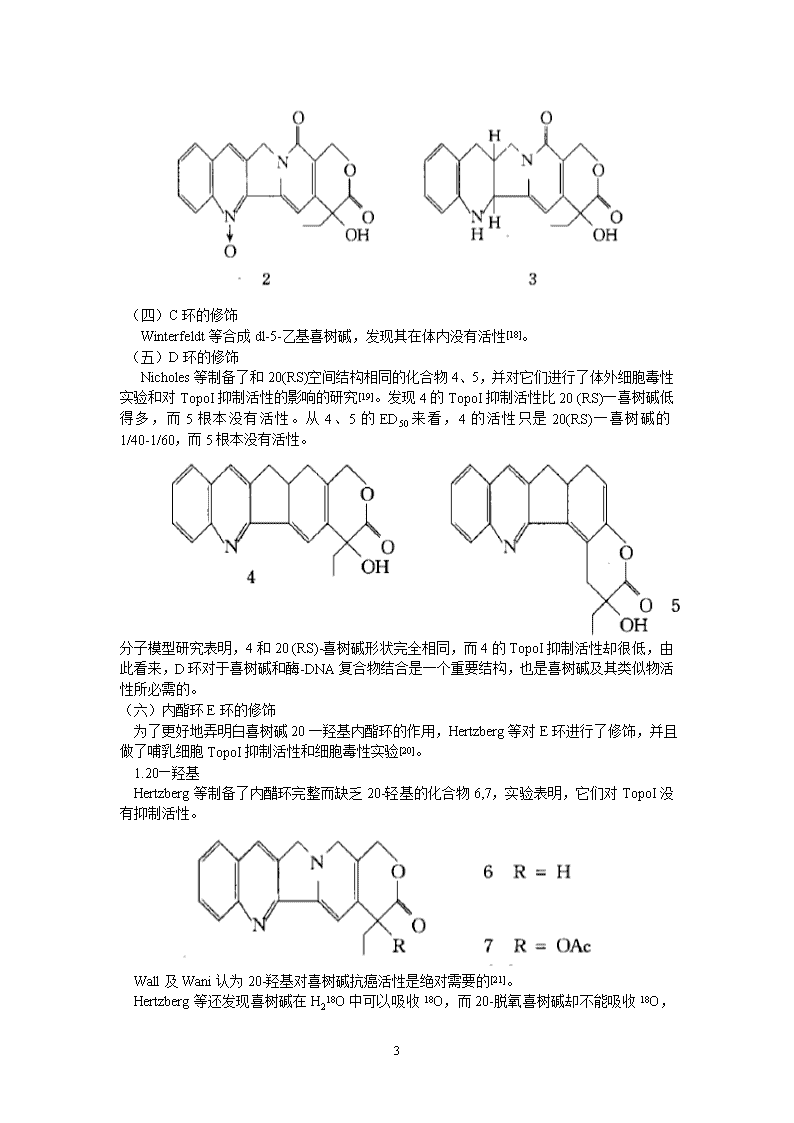
(四)C环的修饰Winterfeldt等合成dl-5-乙基喜树碱,发现其在体内没有活性[18]。(五)D环的修饰Nicholes等制备了和20(RS)空间结构相同的化合物4、5,并对它们进行了体外细胞毒性实验和对TopoI抑制活性的影响的研究[19]。发现4的TopoI抑制活性比20(RS)一喜树碱低得多,而5根本没有活性。从4、5的ED50来看,4的活性只是20(RS)一喜树碱的1/40-1/60,而5根本没有活性。分子模型研究表明,4和20(RS)-喜树碱形状完全相同,而4的TopoI抑制活性却很低,由此看来,D环对于喜树碱和酶-DNA复合物结合是一个重要结构,也是喜树碱及其类似物活性所必需的。(六)内酯环E环的修饰为了更好地弄明白喜树碱20一羟基内酯环的作用,Hertzberg等对E环进行了修饰,并且做了哺乳细胞TopoI抑制活性和细胞毒性实验[20]。1.20—羟基Hertzberg等制备了内醋环完整而缺乏20-轻基的化合物6,7,实验表明,它们对TopoI没有抑制活性。Wall及Wani认为20-羟基对喜树碱抗癌活性是绝对需要的[21]。Hertzberg等还发现喜树碱在H218O中可以吸收18O,而20-脱氧喜树碱却不能吸收18O7
,这点发现也说明20-羟基对于喜树碱对TopoI的抑制作用是必要的。2.20—乙基基团Sugasawa等报道,当20-乙基被烯丙基、乙炔基、苯基取代后的类似物对L1210的体内实验仍保持活性,烯丙基取代物甚至比dl一喜树碱活性更强;但20-乙基被苯酸基取代后活性降低;Wall等制备的18-甲氧喜树碱活性和dl-喜树碱相当。因此,20-乙基被适当基团取代后,仍保持甚至提高其活性。3.内酯环Wall等发现喜树碱加入氢氧化钠后,其钠盐形式的活性仅为喜树碱的1/10。Hertzberg等把内酯环中的氧被氮和硫等元素取代后,发现这些化合物均无活性[22]。由此看来,内酯环对于喜树碱抗癌活性是必需的。综上所述,在喜树碱的结构中,至少有三个重要部分对其活性起决定性作用:a)由B、C、D环共同组成的平面结构,此结构对于体外抑制RNA和体内DNA解旋是必需的。b)20、21位羧基内酯环部分,Lown及chen证明当光照射后它能引起TopoI介导的氧依赖性DNA单链断裂。c)A环9、10、11、12位部分,其取代后活性取决于取代基的种类、数目和位置。参考文献[1]Wall,ME.;Wani,MC.;Cook,CE.;PalmerKH.;J.Am.Chem.Soc.1966,88(16),3888[2]徐任生,赵志远,林隆泽,青传风化学学报,1977,35(4),193[3]唐明珠药学通报,1983,18(1),8[4]MatternR,Shau一MingMong.CancerResearch,1987,47:1793一1798.[5]HsiangYH,LiuLF.Cnc;erRes.,1988,48(7):1722-1724.[6]蔡俊超,殷孟光,阂爱珠,冯大为,张薛鑫,化学学报,1981,39(2),171[7]上海药物研究所中华医学杂志,1978,58(9),598[8]Wall,ME.;Wani,MC.;In:CassadyJM.;DourosJD.;eds.AnticancerAgentsBasedonNaturalProductModels.NewYouk,AcademicPress,1980,417[9]徐任生,赵志远,林隆泽,青传风化学学报,1977,35(4),193[10]唐明珠药学通报,1983,18(1),8[11]Wani,MC.;Nicholas,AW.;Wall,ME.;J.Med.Chem.1986,29(11),2358[12]Wani,MC.;Ronman,PE.;Lindley,JT.;Wall,ME.;J.Med.Chem.1980,23(5),554[13]Wani,MC.;Nicholas,AW.;Manikumar,G.;Wall,ME.;J.Med.Chem.1987,30(10),1774[14]Wall,ME.;In:MothesK.andSchreiberK.eds.NaturalProductsDerAlkaloideBerlin,Academic一Ver-lag1969,77[15]Wall,ME.:Wani,MC.;In:LarsenPK.;ChristensenHK.,eds.NaturalProductsandDrugsDevelop-mentCopenhagen,Munksgaard,1984,253[16]Wall,ME.;Wani,MC.;Natsck,SM.;NicholasAW.;J.Med.Chem.1986,29(8),1553[17]Wall,ME.;Biochem.Physiol.AlkaloidsInt.勿mp.1969,1972,4th,77[181Ohlendorf,HW.;Stranghoner,R.;WinterfeldtE.,Synthesis1976,11,741[19]Sugasawa,T.;Toyada,T.;UchidaN.;YamaguchiK.;J.Med.Chem.1976,19(5),575[20]Winterfeldt,E.;PersonalCommunication19797
[21]Nicholas,AW.;Wani,MC.;ManikumarG.;Wall,ME.;Kohn,W.;Pommier,Y.;J.Med.Chem.1990,33(3),972[22]Hertzberg,RP.;Caranfa,叨.;Holden,KG.;Jakas,DR.;Gallagher,G.;Mattem,MR.;Mong,SM.;7
1.dl-10-甲氧基喜树碱的合成2.dl-10-羟基喜树碱的合成在上述合成产物的基础上,在二甲基甲酞胺溶液中,在氯化铜及二甲胺的存在下用空气氧化即得d1-10-甲氧基喜树碱。7
3.20(S)-9-硝基喜树碱的合成4.20(S)-7-烷(芳)酰基喜树碱的合成5.7-对氟苯甲酰基喜树碱的合成7'
您可能关注的文档
- 存款计息及账户结构改造方案说明文档201156终结版
- GBT51087-2015 船厂既有水工构筑物结构改造和加固设计规范完整
- 混凝土结构改造与加固的应用分析
- 钢结构改造合同范本
- 某商业建筑的局部结构改造
- 三,发展重点产业,推动产业结构改造与升级new
- 2019年洛阳第一批普通干线公路路网结构改造安防工程项目
- TY201005A25高层结构改造加固
- 某石化厂主管廊钢结构改造设计
- 石杉碱甲结构改造的研究进展
- 我国商业银行收入结构改造
- 结构改造加固工程合同书(样本)
- 2013年公路路网结构改造工程(地质灾害)安全实施细则
- 组织结构改造方案的评估与建议
- 激素类结构改造--抗炎增强副作用减低
- 结构改造加固施工组织设计方案
- 建筑结构改造加固安全性检测鉴定模板
- 建筑结构改造加固安全性检测鉴定模板