- 156.50 KB
- 4页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
青霉素效价的生物测定【目的】1.了解用杯碟法测定抗生素效价的原理。2.掌握青霉素效价生物测定的具体操作步骤与方法。【概述】抗生素的抗菌特性决定了它的医疗价值,因此,利用他们各自的抗菌活性来测定其效价有着重要的意义。效价的测定法有:液体稀释法、比浊法和扩散法等。本实验采用国际上最常用的杯碟扩散法来测定青霉素的效价。测定时,将规格完全一致的不锈钢小管(即牛津小杯)置于含敏感菌的琼脂平板上,并在牛津小杯中加入已知浓度的标准青霉素溶液和未知浓度的青霉素发酵液。于是,抗生素就自牛津小杯处向平板四周扩散,在抑菌浓度所达范围内敏感菌的生长被抑制而出现抑菌圈。在一定的范围内,抗生素浓度的对数值与抑菌圈直径呈线性关系。因此,只要将被测样品与标准样品的抑菌圈直径进行比较,就可在标准曲线上查得未知样品的抗生素效价值,为科学实验或临床应用提供参考依据。【材料和器皿】⑴菌种:金黄色葡萄球菌(Staphylococcus),产黄青霉(Penicilliumchrysogenum)。⑵培养基:牛肉膏蛋白胨琼脂培养基(作生物测定用时,平板应分上下两层,上层需另加0.5%葡萄糖)。⑶试剂①1%pH6磷酸缓冲液:K2HPO40.2g(或K2HPO4·3H2O0.253g),K2HPO40.8g,蒸馏水100ml。②0.85%Nacl生理盐水溶液。③苄青霉素钠盐:1.667U/mg(1U即1国际单位,等于0.6ug)。⑷其他:牛津小杯[不锈钢小管,内径(6+0.1)mm,外径(8+0.1)mm,高(10+0.1)mm],培养皿(直径90mm,深20mm;大小一致,皿底平坦),试管、滴管、移液管(5、1ml)及大口10ml移液管等。【方法和步骤】1.敏感菌悬液的制备⑴保藏与传代:将测定用的金黄色葡萄球菌在新鲜斜面培养基上传代并保存。注意测定用敏感菌应每隔3周传代一次,菌种可在37℃温箱培养18~20h后,再在室温下置放3~4h,使菌种斜面产生良好的色素,然后将其置于4℃冰箱保存。⑵活化:在使用前先将供试菌株在斜面培养基上连续传代3~4次,使菌种充分恢复其生理性状。⑶制备悬液:将活化的敏感菌斜面,用0.85%生理盐水洗下,经离心后去除上清液,再用生理盐水洗涤1~2次,并将其稀释至一定浓度的悬液。2.青霉素标准溶液的配制(1)青霉素标准母液:准确称取纯苄青霉素钠盐15~20mg,,溶液在一定量的0.2mol/LpH6磷酸缓冲液中,使成2000U/ml的青霉素溶液,然后保持冷藏存放。(2)青霉素标准工作液:使用时以标准母液配成10U/ml青霉素标准测定液,按表I-15-5-加入青霉素标准母液,即配成不同浓度的青霉素标准液。表Ⅰ—15—5—①不同浓度标准青霉素液的配法
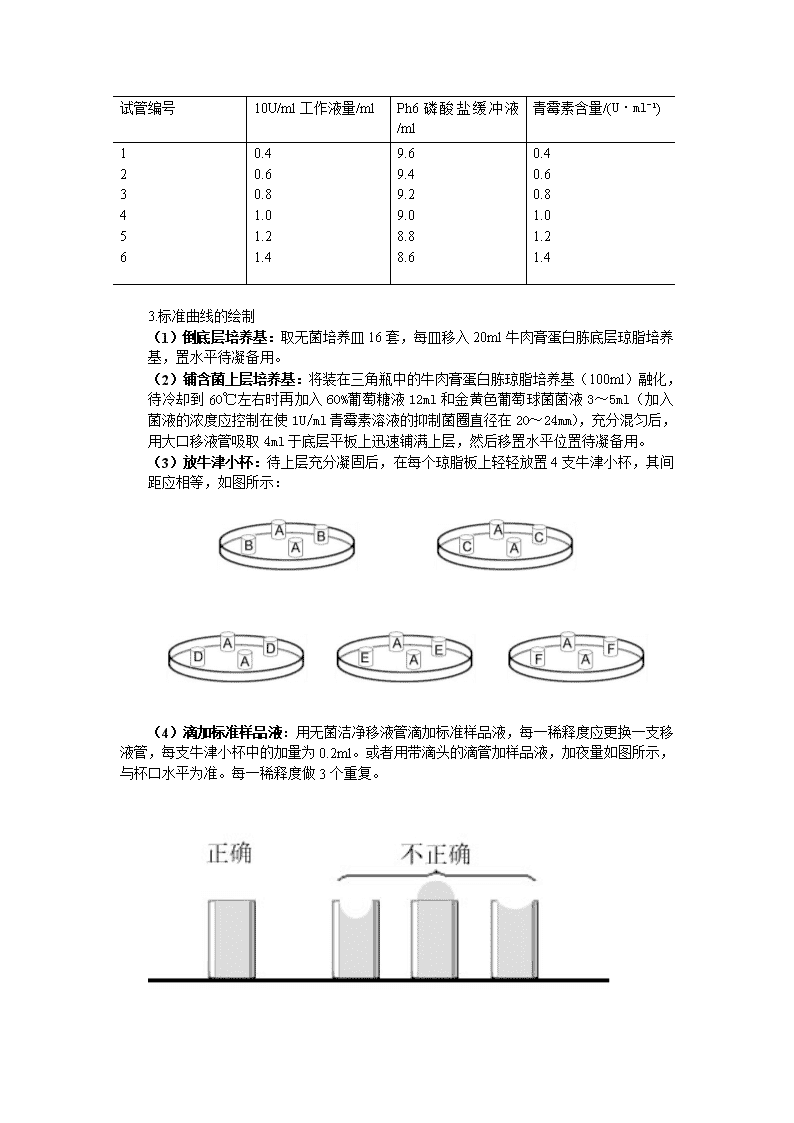
试管编号10U/ml工作液量/mlPh6磷酸盐缓冲液/ml青霉素含量/(U·ml-1)1234560.40.60.81.01.21.49.69.49.29.08.88.60.40.60.81.01.21.43.标准曲线的绘制(1)倒底层培养基:取无菌培养皿16套,每皿移入20ml牛肉膏蛋白胨底层琼脂培养基,置水平待凝备用。(2)铺含菌上层培养基:将装在三角瓶中的牛肉膏蛋白胨琼脂培养基(100ml)融化,待冷却到60℃左右时再加入60%葡萄糖液12ml和金黄色葡萄球菌菌液3~5ml(加入菌液的浓度应控制在使1U/ml青霉素溶液的抑制菌圈直径在20~24mm),充分混匀后,用大口移液管吸取4ml于底层平板上迅速铺满上层,然后移置水平位置待凝备用。(3)放牛津小杯:待上层充分凝固后,在每个琼脂板上轻轻放置4支牛津小杯,其间距应相等,如图所示:(4)滴加标准样品液:用无菌洁净移液管滴加标准样品液,每一稀释度应更换一支移液管,每支牛津小杯中的加量为0.2ml。或者用带滴头的滴管加样品液,加夜量如图所示,与杯口水平为准。每一稀释度做3个重复。
(5)培养:待样品加毕后,最好换上无菌素烧瓷盖(吸湿性号,在盖内不易形成水滴)做培养皿的盖子,并将平板置37℃温箱内培养18~24h后观察测定结果。(6)测量与计算:移去测定培养皿的素烧瓷盖,再将牛津小杯移去,精确地测量各稀释度的青霉素的抑制圈直径(用圆规两脚的针尖测量可提高精度)并记录于下表中。皿号青霉素效价/(U·ml-1)抑菌圈直径/mm平均值/mm校正值/mm1U/ml青霉素抑菌圈直径/mm平均值/mm校正值/mm10.42340.65670.889101.21112131.414151U/ml青霉素抑菌圈直径总平均值=(mm)计算步骤:①算出各组(即各剂量)抑制圈的平均直径。②算出各组1U/ml的抑制圈平均直径。③统计15套培养皿中1U/ml的抑制圈平均值。④以1U/ml抑制圈的总平均值来校正各组的1U/ml抑制圈的平均值,即求得各组的校正值。⑤以各组1U/ml的抑制圈的校正值校正各剂量单位浓度的抑制圈直径,即获得各组抑制圈的校正值。举例:若30个1U/ml青霉素溶液的抑制圈直径的平均值为22.6mm。而第一组内6个1U/ml青霉素溶液的抑制圈直径的平均值为22.4mm,则:第一组的校正值=22.6-22.4=+0.20(mm)。若第一组皿内0.4U/ml青霉素溶液的抑制圈平均值为18.6mm,那么第一组0.4U/ml青霉素溶液的抑制圈校正值=18.6+0.2=18.8(mm)。其他各组依次类推获得各自的校正值。(7)绘制标准曲线:在对数坐标纸上,以青霉素浓度(对数值)为纵坐标,以抑制圈直径的校正值为横坐标,绘制标准曲线。4.青霉素发酵液效价的测定(1)青霉素发酵:用摇瓶或台式发酵罐法接种与培养产黄青霉(青霉素高产分泌菌株)(2)稀释发酵液:作青霉素测定的发酵液用1%pH6.0磷酸盐缓冲液作适当稀释,每个被检验样品用3套培养皿测定其效价。
(3)放牛津小杯:每套含菌测定平半上均匀地放置4支牛津小杯,小杯中心坐落在培养皿两互相垂直直径的各自半径的中心。(4)杯中加样品液:青霉素标准液(1U/ml)与发酵液的稀释液间隔地加入牛津小贝中,加液量务求准确,以降低操作误差。(5)培养与测定:加完样品的平板放37℃下培养18~24h后,测量抑菌圈的直径并记录在下表中。5.青霉素发酵液效价的计算(1)求校正值:将青霉素标准测定也(1U/ml)在8套培养皿中抑菌圈的平均值曲线上1U/ml抑菌圈直径相互比较,以求得其校正值。(2)校正发酵液的值:将此校正值校正被检发酵液抑菌圈直径,以求得他的近似效价值。(3)查对标准曲线值:将此校正值在标准曲线上查得被检青霉素发酵液(稀释液)的效价单位。(4)发酵原液的效价:将上述效价值乘上其稀释倍数,就可求得青霉素发酵液原液的效价值。【结果记录】皿号发酵时间稀释倍数样品稀释液抑菌圈直径/mm平均/mm校正/mm效价/(U·ml-1)发酵液效价/(U·ml-1)1U/ml青霉素抑菌圈直径/mm平均值/mm校正值/mm