- 157.00 KB
- 10页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
葡萄膜炎:暴露于环境中微生物总是坏事吗?(综述)自身免疫反应被认为是由于将眼内抗原被识别为外来抗原所导致。一般认为,暴露于微生物可触发自身免疫反应,其涉及多种机制,例如分子模拟学说、表位扩展、旁激活以及隐蔽抗原的释放等机制。 来自美国的Massilamany博士等讨论了免疫介导的眼内损伤相关机制,并将于2015年6月将其发表于ScandJImmunol上。由于分子模拟学说涉及到诱导交叉反应T细胞介导的葡萄膜炎,对其进行了重点阐述。 葡萄膜炎是色素膜的一种炎症,包括虹膜、睫状体以及脉络膜等结构的炎症。当炎症累及到视网膜时,称为葡萄膜视网膜炎。根据炎症的位置,将葡萄膜炎分为前部葡萄膜炎(角膜、前房、虹膜、睫状体以及晶状体)、中间葡萄膜炎(液化玻璃体、睫状体平坦部、视网膜)和后部葡萄膜炎(凝胶状玻璃体、视网膜、视网膜血管、脉络膜以及视盘)。 出于诊断的目的,要严格区分不同部位的葡萄膜炎。但是,为了便于理解,本综述所指的是更广泛意义的葡萄膜炎,不涉及炎症的具体位置。 眼为免疫赦免器官 传统上来说,眼为免疫赦免器官,有几种相关机制可解释该现象: a两个血眼屏障(BOB),包括血房水屏障(睫状体无色素上皮细胞和虹膜血管内皮细胞)和血视网膜屏障(视网膜血管内皮细胞和视网膜色素上皮细胞),可防止眼内成分进入淋巴或血液,以及包括初始T细胞等的免疫细胞进入眼内。 b前房相关免疫偏离现象导致外周调节T细胞(Treg)的诱导。在此过程中,最初接触抗原后,抗原呈递细胞(APCs)逃离眼睛,而选择性进入脾脏边缘区,促进CD4以及CD8Tregs的产生。
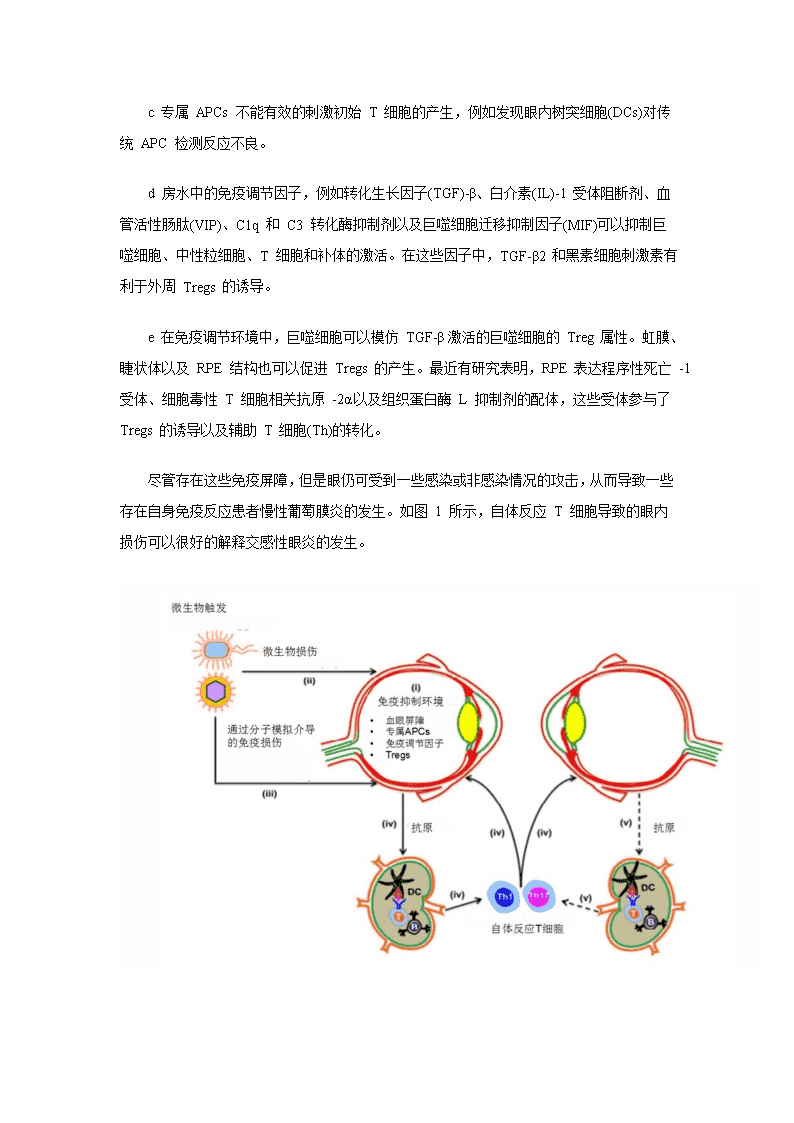
c专属APCs不能有效的刺激初始T细胞的产生,例如发现眼内树突细胞(DCs)对传统APC检测反应不良。 d房水中的免疫调节因子,例如转化生长因子(TGF)-β、白介素(IL)-1受体阻断剂、血管活性肠肽(VIP)、C1q和C3转化酶抑制剂以及巨噬细胞迁移抑制因子(MIF)可以抑制巨噬细胞、中性粒细胞、T细胞和补体的激活。在这些因子中,TGF-β2和黑素细胞刺激素有利于外周Tregs的诱导。 e在免疫调节环境中,巨噬细胞可以模仿TGF-β激活的巨噬细胞的Treg属性。虹膜、睫状体以及RPE结构也可以促进Tregs的产生。最近有研究表明,RPE表达程序性死亡-1受体、细胞毒性T细胞相关抗原-2α以及组织蛋白酶L抑制剂的配体,这些受体参与了Tregs的诱导以及辅助T细胞(Th)的转化。 尽管存在这些免疫屏障,但是眼仍可受到一些感染或非感染情况的攻击,从而导致一些存在自身免疫反应患者慢性葡萄膜炎的发生。如图1所示,自体反应T细胞导致的眼内损伤可以很好的解释交感性眼炎的发生。
图1维持眼内免疫抑制环境有几种因素:(i)BOB;专属APCs;免疫调剂因素如TGF-β、VIP、MIF和Tregs。(ii)暴露于微生物,由于微生物的趋向性可直接导致眼组织损伤。(iii)携带眼内抗原模拟表位的微生物可诱导外周交叉反应性T细胞的产生从而导致眼内炎症。(iv)结果导致新抗原释放,引流到局部淋巴结,导致自体反应性T细胞的产生,产生促炎Th1和Th17细胞因子,且这些因子可迁移并影响患侧眼和健眼。(v)这种恶性环境的延续将导致慢性炎症的产生。 交感性眼炎是一种双侧肉芽肿性葡萄膜炎,可发生于眼睛手术后或外伤后。在这个过程中,可能是由于机体对眼内抗原反应产生T细胞,这些抗原包括葡萄膜黑色素、视网膜S-抗原(S-Ag,也叫做视网膜捕获子)、视紫红质、视黄醇类结合蛋白和损伤眼释放的恢复蛋白,从而产生免疫反应,影响未感染眼。 本质上来说,是由于眼内抗原所产生的初始T细胞进入区域淋巴结而被激活,效应T细胞渗入健侧眼,继而募集中性粒细胞和巨噬细胞,导致未感染眼的损害。 导致葡萄膜炎的因素 健康人外周淋巴细胞包括自体反应T细胞和B细胞。在其运输到外周之前,这两种细胞分别在胸腺和骨髓与自身抗原相互反应。也就是说,健康人有自身免疫性疾病发生的可能性,但是,在临床上却非常少见。如何维持这种耐受性对理解自身免疫性疾病的发生至关重要。有两种主要因素牵涉其中,包括遗传易感性以及暴露于环境中的微生物。 1遗传易感性 主要组织相容性复合体(MHC)基因在疾病的易感性方面扮演着重要的作用。已证明急性前葡萄膜炎与HLA-B27关系密切。白塞氏病与HLA-B51,VKH病与HLA-DR4和HLA-D4单体型,鸟枪弹样脉络膜视网膜病变和交感性眼炎分别与HLA-A29和HL-DR4有关。 MHC基因是T细胞反应的一种决定因素,因为只有在MHC分子存在的条件下,T细胞才可以识别APCs呈递的抗原肽段。在胸腺内成熟的过程中,T细胞既可以识别MHC分子,也可以识别自身抗原,高亲和力相互作用导致阴性选择,弱交互作用导致阳性选择。
然而,如果抗原呈递途径有缺陷,或者胸腺未能表达自身抗原,T细胞可逃避阴性选择。后者是受自体免疫调控元件(AIRE)控制,包括转录调控因子和非-MHC基因都可以影响中枢免疫耐受,控制胸腺自身蛋白的表达。 有两个证据表明AIRE对于中枢免疫耐受起着至关重要的作用。(1)AIRE中人类基因点突变可在各种自身免疫性疾病中呈现。(2)AIRE缺陷鼠可出现包括葡萄膜炎在内的多器官自身免疫疾病,已证明在心、肝、睾丸、胰脏、肾上腺以及眼内都有自身抗体的存在。而且,AIRE缺陷鼠未表达自身抗原,可导致自身器官特异性免疫。 然而,过去我们长期认为眼内抗原处于安静状态,并且不会被胸腺细胞识别。这一概念将会受到挑战。因为已证明胸腺内有多种视网膜抗原,包括IRBP、S-Ag、锥细胞、视蛋白、RPE-65以及黑素细胞特异性抗原。尽管如此,相关蛋白表达的改变仍然会影响胸腺内T细胞的诱导,使其安全运输到外周。 对遗传易感性个体,自体反应性T细胞暴露于环境中微生并反应,从而被激活变为致病细胞。 2环境微生物 一般认为,微生物感染可触发易感人群的自身免疫反应。许多病原体,例如病毒、细菌、原生动物和真菌已证明与葡萄膜炎的发病有关。但仍需明确未检出感染因素情况下长期慢性炎症持续存在的潜在机制。在这种情况下,就需怀疑其是否与自身免疫反应有关,分子模拟学说是解释微生物源性自身免疫疾病的一种主要机制假说。 结构相似的自体抗原或非自体抗原(外来抗原)通过交叉反应促进自体抗原的识别,这一现象称为分子模拟。可发生于T细胞或者抗体水平上。抗体可识别线性微生物序列,也可识别同源非等位序列。抗体通过激活补体途径触发炎症反应。 对于T细胞来说,交叉反应作为一种退化的结果,发生于MHC分子呈递多肽的识别过程中(图2a)。T细胞的退化可在微生物产品中发现,显示为等同于自体蛋白的序列的延伸。如果模仿表位上存在关键MHC和T细胞受体接触残基,多肽碎片即使极少量序列也可被T细胞识别。
图2a:T细胞退化T细胞通过受体识别MHC分子肽段。多肽是通过关键性残基侧链的延长锚定MHC分子,可溶解残基侧链与TCRs接触发挥作用的。主要和次要连接残基在指定位置(P)与MHC和TCR相互作用。在某些情况下,一个单独的残基如P7所示,可与MHC和TCR都连接。如果多肽识别T细胞功能退化,即使主要MHC分子和TCR单独存在,也可识别。这是分子模拟现象的基础,微生物抗原表位共享部分序列,但是保守的关键残基,可以导致交叉免疫反应的激活。 综上所述,微生物的存在可通过分子模拟机制触发葡萄膜炎等自身免疫性疾病的发生。
我们通常使用实验性自身免疫性葡萄膜炎(EAU)模型来确定诱导葡萄膜炎抗原表位的潜在致病性。EAU可以通过使用从视网膜或者虹膜、睫状体提取的蛋白或多肽对易感啮齿类动物进行免疫,配合完全弗氏佐剂而诱导EAU。 葡萄膜炎易感基因蛋白包括S-Ag、IRBP、视紫红质,锥细胞,光导蛋白,RPE-65和I型胶原蛋白。尽管CAR和PVG大鼠对S-Ag易感,但Lewis大鼠使用S-Ag和IRBP都可成功诱导EAU。 相反,小鼠EAU只能通过IRBP诱导;其易感基因肽段包括B10.RIII小鼠易感的IRBP161-180、IRBP171-190和IRBP541-560;B10.A、B10.BR和A/J小鼠易感的IRBP201-216;C57BL/6易感的IRBP1-20、IRBP461-480和IRBP651-670。这些模型中,自体反应性T细胞参与疾病的致病过程。 对于其他自身免疫性疾病,T细胞辅助因子(最重要的是Th17细胞因子)在EAU致病过程中发挥促进炎症反应的作用,Th2细胞因子可抑制疾病。表明致病性模拟抗原表位可诱导产生Th17细胞因子的交叉反应性T细胞。 已有报道认为模拟表位能够通过自身蛋白、乳清蛋白和微生物诱导葡萄膜炎。HLA-B(HLA-B27PD125-138)、牛α2酪蛋白(Cas73-84)、病毒蛋白衣壳(VP)4和人类轮状病毒(VP4591-601)可通过模仿同源表位S-Ag341-355,诱导T细胞交叉反应而造模Lewis大鼠的EAU。 同样,S-Ag(S-Ag303-320)若干不同来源模拟肽段也可诱导葡萄膜炎。包括来源于E.coli假想蛋白的两个多肽(ECHP9和ECHP11);3种来源于病毒的多肽,包括乙肝病毒DNA聚合酶(HBVDP404-415)、AKV鼠白血病病毒多聚蛋白聚合酶(AKVMLVGP347-358)和狒狒内源性病毒多聚蛋白聚合酶(BEVGP354-365);以及来源于马铃薯蛋白酶Iia的多肽。 一般认为暴露于包含自体抗原的模拟抗原表位的微生物导致致病T细胞或抗体交叉反应。然而最近有研究表明,使用IRBP201-216作为靶抗原,从各种微生物来源识别出48种新的模仿序列。其中,犬埃利希体(EHC)44-59,诱导T细胞交叉反应(图2b)。
图2b:同源(IRBP)和模拟多肽(EHC)序列的比较IRBP210-216和EHC44-59之间的氨基酸序列相比较表明有56%的同一性,显示二者间相似或不同的残基。 值得注意的是,EHC是一种特异性的立克次氏体病原体,可诱导犬类葡萄膜炎和视神经炎,但是,尚没有研究自身免疫反应在动物的影响。对我们而言,尽管EHC44-59可以产生Th1和Th17细胞因子,但是无法诱导EAU。相反,模拟抗原可以抑制IRBP201-216产生EAU,这可归因于一种自然发生的变构肽配体(APL)。 这种现象以前也曾有报道发生于一种自我抗原,髓鞘碱性蛋白87-99,诱导自身免疫性脑脊髓膜炎的文章中。这就提出一个问题,即分子模拟与自身免疫性疾病相关性问题,特别是眼部疾病。 而且,与T细胞相似,自身抗体交叉反应也发生在暴露于环境中微生物携带模拟表位的情况下,如S-Ag的模拟表位链球菌M蛋白;α-晶体蛋白的模拟表位钩端螺旋体复发葡萄膜炎相关蛋白-(lru)A,波形纤维蛋白和β-晶体蛋白B2的模拟蛋白lruB;玻璃体抗原的模拟表位克雷伯氏菌成分。 同样地,有报道表明自身抗体也可存在于微生物感染的情况下,而与交叉免疫反应的发生无关。例如,兔子感染弓形虫,可出现S-Ag和视网膜多肽-35抗体。同样,证实了人类视网膜中提取抗体在慢性弓形虫病患者并未出现任何明显症状。且弓形虫视网膜脉络膜炎患者可发现视网膜Gal-1和S-Ag抗体的升高。
尽管有很多报道证明了其他各种微生物的类似情况,如耶尔森菌、分枝杆菌、巴尔通氏体、幽门螺旋杆菌和肾脏钩端螺旋体。但是,自身抗体在这些感染中的病理意义仍未知。 如图3所示,忽略微生物对眼的趋向性,微生物都可导致眼损伤,但是他们导致疾病的机制不同。眼内病原体可以打破BOB,直接导致组织的物理损伤,从而导致急性葡萄膜炎。 图3眼部感染的假设结果微生物眼部感染可引起急性葡萄膜炎,病原体自发或者经过治疗后清除,炎症可消退。但是,当病原体持续存在,就可导致慢性炎症的发生。相反,暴露于携带模拟表位的微生物,忽略其眼的特异性,可诱发交叉免疫反应,从而导致多种结果。包括慢性疾病、无疾病或者通过APL机制抑制疾病。然而,如果是由病原体本身或者交叉免疫反应造成的初始损伤引起的慢性炎症,新的眼内抗原将会释放,成为免疫攻击的靶点。这些事件的发生将会导致炎症的持续。这可能就是未检出感染微生物但仍存在慢性炎症的原因,即眼部感染造成的自身免疫反应。
毒素介导的组织损伤和微生物分泌的蛋白酶导致眼内抗原的释放。这些抗原包括IRBP、锥细胞、葡萄膜黑色素,视网膜S-Ag,光导蛋白,视紫红质/视蛋白以及酪氨酸酶相关蛋白1和2。且这些抗原被免疫系统识别为外来抗原。 一旦机体被感染,炎症细胞就会募集到局部感染区域,进而加重组织损伤。微生物感染诱导的眼内疾病,无论治疗与否,可以自发清除病原体。但是,如果病原体持续存在,则将发展为慢性疾病。 另外,暴露于携带视网膜抗原模仿表位的微生物,不考虑抗原对眼睛的趋向性,可以有三种后果: 1)致病交叉T细胞反应诱导的免疫损伤,导致眼急性或慢性损伤。在此过程中,释放新的眼内抗原,免疫系统可识别并将其作为靶点,导致新的自体反应性T细胞的激活。这种现象称为表位扩展,可导致炎症的延续。 2)可发生无病理损伤的交叉T细胞反应,或所谓的无菌反应。 3)交叉T细胞反应有可能对宿主有益。如我们先前提到的模拟表位EHC44-59,可以抑制IRBP201-216诱导产生的疾病。 另外,鉴于调节性T细胞在抑制自体反应性效应T细胞的反应的扩大方面发挥重要作用,T细胞可识别携带模拟表位的微生物抗原产生调节性T细胞,从而抑制先前提到的致病性交叉免疫反应。 结论 此前,已证明有多种视网膜抗原模拟表位可诱导Lewis大鼠EAU的产生。基于我们EAU小鼠模型的数据,我们提出,暴露于携带有眼内抗原模拟表位的微生物不一定导致疾病;相反,这些模拟表位有可能抑制疾病的发生。而且,中枢免疫系统作为一种免疫赦免器官已证明有这种现象。
我们推测其为典型的宿主-寄生虫关系,携带模拟表位的微生物可诱导致病交叉免疫反应,这些结果不利于寄生虫的生存。或者,寄生虫和宿主可能共存,寄生虫可获得宿主的遗传物质,通过加强宿主对其的耐受而生存。