- 569.50 KB
- 16页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
生物化学教学大纲开课院系:海洋生命学院海洋生物系课程教学目标与基本要求:通过本课程的学习,要求生物科学及相关专业学生较全面了解生物体的基本化学组成,理解其主要组成物质的结构特点、性质和功能以及这些物质在体内的合成、降解、相互转化及调控等的代谢规律,深入了解这些代谢活动与各种重要生命现象之间的关系。掌握常用的生物化学研究方法,学会综合运用所学的基本理论知识和技术来解决一些实际问题,并为学习后续课程打好基础。授课内容与学时分配:教学内容教学目标授课方式课时章具体内容第一章绪论一、生物化学的含义理解生物化学的涵义多媒体2学时第1周二、生物化学的分类了解生物化学研究内容三、生物化学的发展史通过学习生物化学发展简史明确生物化学与其它学科的关系、生物化学在整个生命科学中的重要地位㈠历史背景㈡生物化学的诞生㈢生物化学的建立㈣发展中的生物化学四、中国对生物化学的贡献了解我国科学家对生物化学的贡献五、生物化学的应用了解生物化学在工农业生产中的应用明确生物化学的学习方法第二章糖类生物化学一、糖类化学概论了解糖的现代概念、分类及生物功能 多媒体讨论4学时第1-2周㈠糖类的概念与分类㈡糖类分布及重要性二、单糖
掌握单糖的分子结构、性质和几种重要单糖的分子结构 ㈠、单糖的分子结构㈡、单糖的性质㈢、单糖衍生物三、寡糖 了解常见寡糖的结构、性质 ㈠、二糖㈡、三糖㈢、寡糖链四、多糖 掌握几种常见多糖的结构、性质和生物功能 ㈠概述㈡同多糖㈢、杂多糖五、结合糖 重点掌握糖蛋白、蛋白聚糖的概念、结构、类型,寡糖链的类型、结构及生物学特性和功能了解糖肽的结构、作用㈠、糖蛋白㈡、蛋白聚糖㈢、糖肽第三章脂类化学一、概论了解脂类的概念、分类和生物学功能多媒体2学时第2周㈠、脂类的概念及生物学功能㈡、脂类的分类二、脂酰甘油类了解脂酰甘油类的概念、类型,甘油三酯的类型和性质㈠、脂肪酸㈡、甘油三酯的物理与化学性质三、磷脂类 掌握磷脂的基本结构、常见磷脂的结构、性质和生物功能㈠、甘油磷脂的结构㈡、常见的甘油磷脂㈢、醚甘油磷脂㈣、鞘磷脂
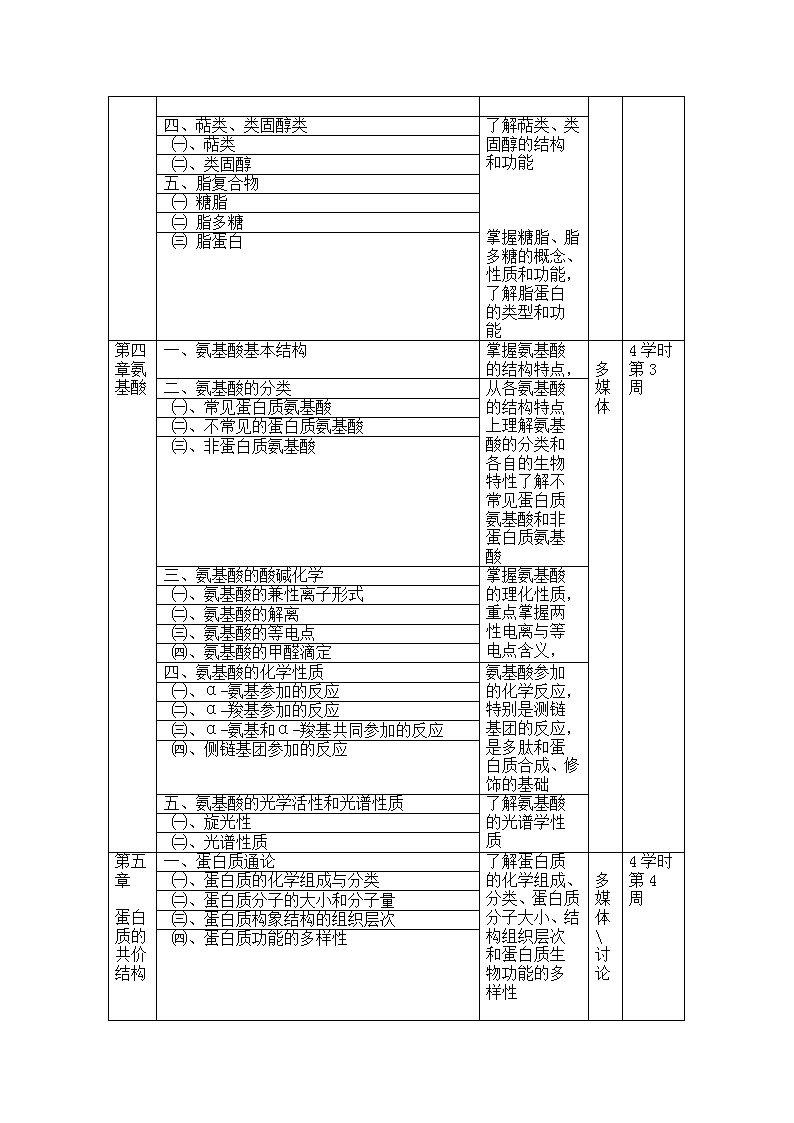
四、萜类、类固醇类了解萜类、类固醇的结构和功能掌握糖脂、脂多糖的概念、性质和功能,了解脂蛋白的类型和功能㈠、萜类㈡、类固醇五、脂复合物㈠糖脂㈡脂多糖㈢脂蛋白第四章氨基酸一、氨基酸基本结构掌握氨基酸的结构特点,多媒体4学时第3周二、氨基酸的分类从各氨基酸的结构特点上理解氨基酸的分类和各自的生物特性了解不常见蛋白质氨基酸和非蛋白质氨基酸㈠、常见蛋白质氨基酸㈡、不常见的蛋白质氨基酸㈢、非蛋白质氨基酸三、氨基酸的酸碱化学掌握氨基酸的理化性质,重点掌握两性电离与等电点含义,㈠、氨基酸的兼性离子形式㈡、氨基酸的解离㈢、氨基酸的等电点㈣、氨基酸的甲醛滴定四、氨基酸的化学性质氨基酸参加的化学反应,特别是测链基团的反应,是多肽和蛋白质合成、修饰的基础㈠、α-氨基参加的反应㈡、α-羧基参加的反应㈢、α-氨基和α-羧基共同参加的反应㈣、侧链基团参加的反应五、氨基酸的光学活性和光谱性质了解氨基酸的光谱学性质㈠、旋光性㈡、光谱性质第五章蛋白质的共价结构一、蛋白质通论多媒体讨论4学时第4周
了解蛋白质的化学组成、分类、蛋白质分子大小、结构组织层次和蛋白质生物功能的多样性㈠、蛋白质的化学组成与分类㈡、蛋白质分子的大小和分子量㈢、蛋白质构象结构的组织层次㈣、蛋白质功能的多样性二、肽了解肽、肽键的概念、结构和常见肽的性质、作用㈠、肽和肽键的结构㈡、肽键的特点㈢、肽的物理和化学性质㈣、天然存在的活性肽三、蛋白质一级结构测定掌握蛋白质一级结构的概念,蛋白质一级结构的测定方法与思路,能根据实验结果分析简单多肽的氨基酸顺序 ㈠、测定蛋白质的一级结构的要求㈡、蛋白质测序策略㈢、测定步骤㈣、蛋白质测序举例㈤、蛋白质序列数据库四、蛋白质的氨基酸序列与生物功能了解蛋白质一级结构和生物功能的关系㈠、同源蛋白质的物种差异与生物进化㈡、同源蛋白质具有共同的进化起源㈢、一级结构的局部断裂与蛋白质激活第六章蛋白质的三维结构一、研究蛋白质构象的方法了解研究蛋白质构象的方法多媒体讨论5学时第5周二、稳定蛋白质三维结构的作用力掌握稳定蛋白质三级结构的作用力的类型、形成机理和作用㈠、氢键㈡、范德华力㈢、疏水作用㈣、离子键㈤、二硫键三、多肽主链折叠的空间限制了解多肽链折叠的空间限制㈠、酰胺平面与α-碳原子的二面角㈡、可允许的ψ和Φ值四、二级结构掌握蛋白质二级结构的概念、类型、结构特点多媒体讨论5学时第5周㈠、α-螺旋㈡、β-折叠片㈢、β-转角和β-凸起㈣、无规则卷曲五、纤维状蛋白质了解纤维蛋白的结构特点和功能㈠、角蛋白㈡、胶原蛋白
六、超二级结构和结构域掌握超二级结构、结构域、三级结构的概念、类型、结构特点㈠、超二级结构㈡、结构域七、球状蛋白质与三级结构掌握三级结构的概念、类型、结构特点 掌握膜蛋白的类型、结构特点和功能㈠、球状蛋白质的分类㈡、球状白分子三维结构的特征八、膜蛋白的结构㈠、膜内在蛋白㈡、脂锚定蛋白九、蛋白质折叠和结构预测了解蛋白质折叠的热力学、动力学和蛋白质结构预测的规则㈠、蛋白质的变性㈡、氨基酸序列规定蛋白质的三维结构㈢、蛋白质折叠的热力学㈣、蛋白质折叠动力学㈤、蛋白质的结构预测十、亚基缔合和四级结构了解蛋白质四级缔合的概念、作用力、方式和优越性 ㈠、有关四级结构的一些概念㈡、四级缔合的驱动力㈢、亚基相互作用的方式㈣、四级结构的对称性㈤、四级缔合在结构和功能上的优越性第七章蛋白质结构与功能的关系一、肌红蛋白质的结构与功能掌握肌红蛋白结构特征;氧结合的动力学特征及对结构的影响多媒体讨论4学时第6周㈠、肌红蛋白质的三级结构㈡、辅基血红素㈢、氧与肌红蛋白的结合㈣、氧的结合改变肌红蛋白的构象㈤、肌红蛋白氧结合曲线二、血红蛋白的结构与功能掌握血红蛋白的结构特征;氧结合的动力学特征及对结构的影响;血红蛋白运输氧高效性的特点;㈠、血红蛋白的结构㈡、氧结合引起的血红蛋白构象变化㈢、血红蛋白的氧结合曲线三、血红蛋白的分子病了解血红蛋白分子病和结构变异对功能的影响㈠、镰刀状细胞贫血病㈡、地中海贫血病
四、免疫球蛋白结构与相关生化技术了解免疫球蛋白的结构、类型,掌握westernblot和免疫印迹技术的原理和用途㈠、免疫球蛋白的结构㈡、免疫球蛋白的类别㈢、基于抗体-抗原作用的生化分析方法第八章酶通论一、酶催化作用的特点了解酶作为生物催化剂的特点,多媒体3学时第7周㈠、酶和一般催化剂的比较㈡、酶作为生物催化剂的特点二、酶的本质、分类与命名酶的化学本质、分类和命名原则㈠、酶的化学本质㈡、蛋白酶的分类㈢、蛋白酶的命名三、酶作用专一性机理掌握酶的专一性及其机理㈠、锁与钥匙学说㈡、“三点结合”的催化理论㈢、诱导契合学说四、酶的活力测定和分离纯化掌握酶活力、比活力、总活力的概念和测定方法㈠、酶活力测定㈡、酶活力测定实例五、核酶掌握核酶、抗体酶的概念,㈠、核酶的概念㈡、核酶的种类㈢、核酶研究的意义及应用前景六、抗体酶了解核酶的类型和抗体酶的诱导原理。七、酶工程简介了解酶工程的概念和研究范畴,常见酶工程的技术㈠、化学酶工程㈡、生物酶工程第九章酶促反应动力学一、化学动力学基础了解化学反应的动力学基础多媒体讨论1学时第7周㈠、反应速率及其测定㈡、反应分子数和反应级数二、底物浓度对酶反应速度的影响重点掌握酶促反应动力学:米氏方程推导过程米氏方程
掌握过渡态理论含义,了解过渡态底物类似物对酶的抑制作用。㈠、中间络合物学说㈡、酶促反应的动力学方程式(单底物)㈢、酶促反应的动力学方程式(多底物)三、酶的抑制作用掌握三种可逆抑制作用的动力学特点㈠、抑制程度的表示方法㈡、抑制作用类型㈢、可逆抑制的动力学㈣、一些重要的抑制剂四、温度对酶反应速度的影响掌握温度对酶反应速度的影响五、pH对酶反应速度的影响掌握pH对酶反应速度的影响六、激活剂对酶反应速度的影响掌握激活剂对酶反应速度的影响第十章酶的作用机制和酶的调节一、酶的活性部位理解、掌握酶活性部位的相关概念和特点多媒体讨论3学时第8周㈠、酶的活性部位的特点㈡、研究酶活性部位的方法二、酶催化反应的独特性质掌握酶催化反应的性质三、影响催化效率的有关因素掌握酶催化高效性的相关机理㈠、底物和酶的邻近效应与定向效应㈡、底物的形变和诱导契合㈢、酸碱催化㈣、共价催化㈤、金属离子催化㈥、多元催化和协同效应㈦、活性部位的微环境的影响四、催化反应机制的实例了解几种酶的催化机制,理解结构和功能的适应性了解酶活性的调节方式,㈠、溶菌酶㈡、胰核糖核酸酶A㈢、丝氨酸蛋白酶㈣、天冬氨酸蛋白酶五、酶活性的调节控制掌握酶活性的别构调节、可逆共价调节和酶原激活调节方式及生物代谢中的作用㈠、别构调控㈡、酶原激活㈢、可逆的共价修饰㈣、同工酶第十一章一、维生素概论1学时第8周
维生素和辅酶了解维生素的分类及各种维生素的结构、生物功能以及缺陷症多媒体讨论㈠、维生素的概念㈡、维生素的发现二、脂溶性维生素了解脂溶性维生素的结构和功能㈠、维生素A族 ㈡、维生素D族㈢、维生素E㈣、维生素K三、水溶性维生素重点掌握维生素B与辅酶的关系以及在代谢中的催化作用㈠、维生素B1和硫胺素焦磷酸㈡、维生素PP和烟酰胺辅酶㈢、维生素B2和黄素辅酶㈣、维生素B3(泛酸)和辅酶A㈤、维生素B6和磷酸吡哆醛、磷酸吡哆胺㈥、维生素B12(氰钴胺素)及辅酶㈦、维生素B7(生物素)㈧、叶酸和四氢叶酸㈨、硫辛酸㈩、维生素C四、作为辅酶的金属离子了解金属离子作为辅酶的意义㈠、概论㈡、金属酶类和金属激活酶类第十二章生化分离技术及应用一、离心机掌握离心机的原理和应用多媒体讨论4学时第9周㈠、离心机的种类㈡、原理和相关概念㈢、离心技术类型二、层析掌握层析技术的原理和应用㈠、概述㈡、分配层析技术㈢、吸附层析技术㈣、疏水作用层析㈤、凝胶过滤层析技术㈥、离子交换层析法㈦、亲和层析㈧、高效液相层析和快速蛋白液相层析三、电泳掌握电泳技术的原理和应用㈠、概述㈡、电泳的基本原理㈢、聚丙烯酰胺凝胶电泳四、蛋白质的性质
了解蛋白质的物理性质及沉淀机理掌握蛋白质分离纯化的一般步骤和原则,能根据特定条件设计分离纯化方案㈠蛋白质的酸碱性质㈡、蛋白质的沉淀五、蛋白质分离纯化掌握蛋白质含量、纯度和分子量的测定方法和原理 ㈠、概述㈡、蛋白质混合物纯化方法㈢、蛋白质的含量测定与纯度鉴定㈣、蛋白质相对分子量的测定方法㈤、酶的分离提纯第十三章核酸一、核酸概论了解核酸的种类、分布掌握核酸的生物功能,特别是RNA的生物功能多媒体讨论3学时第10周㈠、核酸的发现和研究简史㈡、核酸的种类别和分布㈢、核酸的生物功能二、酸的结构掌握几种重要核苷酸的结构和性质,核酸的一级、二级和高级结构及特征㈠、核苷酸㈡、核酸的共价结构㈢、DNA的高级结构㈣、核糖核酸(RNA)的高级结构三、核酸的物理化学性质掌握核酸水解、紫外吸收、变性、复性等的理化性质㈠、核酸的水解㈡、核酸的酸碱性质㈢、核酸的紫外吸收㈣、核酸的变性、复性及杂交四、核酸的研究方法掌握核酸常见研究方法和原理㈠、核酸的分离、提纯和定量测定㈡、核酸的超速离心㈢、核酸的凝胶电泳㈣、核酸的核苷酸序列测定㈤、DNA聚合酶链反应(PCR)㈥、DNA的化学合成第十四章代谢总论一、基本概念了解代谢的基本概念多媒体1学时第10周二、代谢的基本特点
掌握代谢的基本特征㈠、代谢途径是系列酶促反应㈡、代谢总轮廓㈢、分解代谢和合成代谢途径通常不重和,存在重要的差异㈣、代谢途径存在区隔化㈤、ATP是代谢反应中能量转移的重要载体㈥、细胞代谢是经济而精密的调节过程三、新陈代谢研究方法了解新陈代谢研究方法四、学习方法了解代谢的学习方法第十五章糖酵解一、糖酵解研究简史了解糖酵解的研究历史,多媒体讨论4学时第11周二、糖酵解全过程掌握糖酵解的十步反应过程三、糖酵解的反应机制掌握、参与的酶和反应机理,能量代谢,生理作用和代谢调节四、糖酵解全过程总结掌握糖酵解全过五、糖酵解的生理作用掌握糖酵解的生理意义六、糖酵解作用的调节掌握糖酵解作用的几种调节方式七、其他六碳糖进入糖酵解途径其他六碳糖单糖进入糖酵解的方式八、丙酮酸去路掌握丙酮酸去路第十六章柠檬酸循环一、柠檬酸循环概貌掌握柠檬酸循环概念多媒体讨论2学时第12周二、柠檬酸循环的反应机制掌握柠檬酸循环的过程三、柠檬酸循环总结掌握柠檬酸循环的机理、能量代谢过程四、柠檬酸循环的生理意义掌握柠檬酸循环的生理意义五、柠檬酸循环的调控掌握柠檬酸循环调节方式六、柠檬酸循环的回补反应了解柠檬酸循环的回补反应七、乙醛酸途径了解乙醛酸循环途径
第十七章生物氧化一、生物氧化概论了解生物氧化的概念多媒体讨论4学时第12-13周二、生物氧化体系的类型了解生物氧化体系的类型三、电子传递链的组成和性质掌握电子传递链的组成成分的结构和电子传递过程㈠、NADH-Q还原酶㈡、辅酶Q㈢、琥珀酸-Q还原酶㈣、细胞色素还原酶㈤、细胞色素C㈥、细胞色素氧化酶四、电子传递的抑制剂了解电子传递抑制剂和氧化磷酸化解偶联剂类型和作用点五、氧化磷酸化掌握ATP合酶的结构、氧化磷酸化的机制和电子传递和氧化磷酸化的耦联机制, ㈠、氧化磷酸化假说㈡、ATP合酶结构㈢、结合变化学说㈣、电子传递和氧化磷酸化机制六、细胞溶胶内NADH的再氧化细胞溶胶内NADH再氧化途径,七、葡萄糖彻底氧化产生ATP会计算葡萄糖等物质完全氧化能量代谢第十八章糖的其他代谢途径一、葡萄糖异生作用掌握葡萄糖异生作用途径、生理意义和调节多媒体讨论4学时第13-14周㈠、糖异生的前体㈡、糖异生途径㈢、糖异生的生理意义㈣、糖异生的调节二、戊糖磷酸途径
掌握磷酸戊糖途径代谢过程,意义和调节,特别是该途径与糖酵解、糖异生途径共同适应不同细胞代谢状态的调节㈠、戊糖磷酸途径研究史㈡、戊糖磷酸途径主要反应㈢、代谢调节三、淀粉和糖原代谢掌握糖原分解和合成相关酶及调节㈠、淀粉分解代谢㈡、糖原分解代谢㈢、糖原的生物合成㈣、糖原代谢的调节四、复合糖糖链的合成了解复合糖寡糖链的合成过程第十九章脂肪酸的分解代谢一、甘油三脂的分解代谢了解甘油三酯的分解代谢多媒体讨论1学时第14周㈠、体内甘油三脂的分解㈡、甘油的代谢二、脂肪酸的氧化掌握脂肪酸的氧化过程、能量代谢㈠、饱和脂肪酸的β-氧化㈡、不饱和脂肪酸的氧化㈢、脂肪酸的α-和ω-氧化三、磷酸甘油脂的分解代谢(略)了解磷脂的分解代谢第二十章脂肪酸的合成一、脂肪酸的来源了解体内脂肪酸的来源多媒体讨论1学时第14周二、脂肪酸的合成掌握脂肪酸的生物合成途径和能量代谢 脂肪酸合成和分解的异同点和调节㈠、软脂酸的生物合成㈡、脂肪酸碳链的延长㈢、碳链的去饱和㈣、脂肪酸降解和合成的调节三、甘油三脂的合成了解甘油三脂的合成四、磷脂类的生物合成了解磷脂的生物合成一、蛋白质的降解了解蛋白质的降解过程多媒体讨论2学时第15周
第二十一章蛋白质分解和氨基酸代谢㈠、内源蛋白质的降解㈡、外源蛋白质的降解㈢、氮平衡二、氨基酸的分解代谢掌握氨基酸的去氨基途径、尿素循环㈠、氨基酸氨基的转移㈡、氨基酸的脱羧基作用㈢、氨的命运㈣、尿素循环㈤、氨基碳骨架的氧化途径三、氨基酸的合成(略)了解氨基酸碳骨架的代谢和氨基酸合成的主要路线第二十二章核酸降解和核苷酸代谢一、核酸的解聚和核苷酸的降解了解核酸降解过程多媒体讨论2学时第15周二、碱基降解掌握嘌呤碱和嘧啶碱基降解过程㈠、嘌呤碱的分解掌握核苷酸、脱氧核糖核苷酸合成与调节㈡、嘧啶碱三、核苷酸的生物合成㈠、嘌呤核糖核苷酸的合成㈡、嘧啶核糖核苷酸的合成㈢、脱氧核糖核苷酸的合成㈣、核苷酸代谢调控第二十三章DNA的复制一、DNA的半保留复制了解DNA的半保留多媒体讨论2学时第16周二、DNA复制的起点和方式掌握复制的起点和方式三、DNA的半不连续复制掌握半不连续复制四、DNA复制有关的酶和蛋白质重点掌握DNA复制相关酶和蛋白质 掌握大肠杆菌DNA复制过程,特别是起始过程和调节;㈠、DNA聚合酶㈡、拓扑异构酶㈢、解螺旋酶㈣、引物合成酶㈤、DNA连接酶㈥、复制相关蛋白五、大肠杆菌DNA复制过程六、真核生物DNA复制
真核生物DNA复制的特点及与原核生物的异同了解真核生物端粒复制㈠、真核生物DNA复制㈡、真核生物端粒复制第二十四章RNA的生物合成和加工一、DNA指导下RNA合成了解RNA合成的范畴,启动子、转录因子、终止子和终止因子的概念多媒体讨论2学时第16周㈠、概述㈡、DNA指导下的RNA聚合酶㈢、启动子和转录因子㈣、终止子和终止因子㈤、转录过程㈥、RNA生物合成的抑制剂二、RNA的转录后加工掌握RNA聚合酶的特性和转录过程,特别是转录起始和终止㈠、原核生物RNA的加工㈡、真核生物RNA加工三、RNA指导下的RNA合成掌握RNA转录后加工的方式和过程四、RNA指导下的DNA合成掌握逆转录过程和逆转录酶第二十五章蛋白质合成和转运一、蛋白质合成的分子基础了解蛋白质合成的分子基础和作用多媒体讨论2学时第17周㈠、mRNA是蛋白质合成的模板㈡、遗传密码㈢、tRNA转运活化的氨基酸㈣、核糖体是蛋白质合成的工厂二、蛋白质合成过程掌握蛋白质合成的过程,氨酰tRNA酶特性、原核和真核生物蛋白质合成起始复合物形成了解蛋白质合成的抑制剂㈠、氨酰tRNA合成酶催化形成氨酰tRNA㈡、原核生物蛋白质合成的起始㈢、原核生物蛋白质合成的延伸㈣、蛋白质合成的终止㈤、真核生物起始复合物的形成㈥、蛋白质合成的抑制剂三、蛋白质合成的修饰和定向转运
了解蛋白质合成后的修饰和定向转运过程第二十六章代谢调控一、物质代谢途径的相互联系掌握整个代谢途径间的相互关系 多媒体讨论1学时第17周㈠、糖代谢与脂代谢的联系㈡、糖代谢与氨基酸代谢的关系㈢、氨基酸代谢与脂代谢的关系㈣、核苷酸代谢与糖、脂、氨基酸的关系二、物质代谢的特点掌握物质代谢的特点 ㈠、TCA是中心环节㈡、分解合成途径往往分开,非简单逆反应㈢、ATP是通用的能量载体㈣、分解为合成提供还原力和能量㈤、分解、合成受不同方式调节三、代谢调节理解酶活性调节、细胞结构、神经和激素对整个代谢过程的调节作用 ㈠、酶水平的调节㈡、细胞水平的调节㈢、激素水平的调节 生物化学实验课程教学大纲 撰写人:刘晨光于乐军撰写时间:2006年9月1日开课院系:海洋生命学院课程编号:073102102207课程名称:生物化学实验英文名称:GeneralBiochemistryLaboratory推荐使用教材:生物化学实验 编者:陈钧辉等 出版社:科学出版社 出版时间及版次:2003年第三版 课程总学时:34总学分:1周学时:3学期安排:2006-2007学年第一学期实验、实习场所(校内、野外、海上等):校内课程教学目标与基本要求:生物化学实验是生物化学教学的重要组成部分,与理论教学既有联系又相对独立的组成部分。本课程以构成生物机体的主要有机物质如糖类、蛋白质、脂肪、核酸及其相关研究技术为主线,选择实验内容。通过实验教学一方面可以使学生巩固和加深《生物化学》的基础理论知识,而更重要的是通过实验培养学生动手能力和从事相关科研工作的能力,进一步加强学生独立分析问题和解决问题、综合设计及创新等方面的能力。
经过实验训练后,学生应达到下列要求:1.巩固和加深对生物化学基本知识的理解,掌握生物化学实验的基本知识和基本操作技能,并掌握仪器操作原理。2.提高观察问题、分析问题和解决问题的能力。通过独立思考,深入钻研有关问题,具有初步解决生物化学实验问题的能力。3.能独立设计实验,利用所学知识准确分析实验结果。考核方式:考查课程内容与学时分配:项目序号实验、实习授课内容学时(周)基础性实验综合性实验研发性实验1实验一蛋白质的颜色反应 3学时2实验二蛋白质的沉淀反应 3学时3实验三用Folin-Wu法定量测定血糖的含量 3学时4实验四肝糖元的提取和鉴定 3学时5实验五双缩脲法测定蛋白质的浓度 3学时6实验六氨基酸的纸层析法 3学时7实验七醋酸纤维薄膜电泳法分离牛血清蛋白 3学时8实验八酵母RNA的提取及鉴定 3学时9实验九维生素C的定量测定(2,6-二氯靛酚滴定法) 3学时10实验十DNA的定量测定-二苯胺法 3学时11实验十一聚丙烯酰胺凝胶盘状电泳法分离牛血清蛋白 4学时 学习参考书(编者,出版社,出版时间及版次):1基础生物化学实验.王秀奇.高等教育出版,1999年第二版