- 500.00 KB
- 19页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
第十三章溶液热力学基础§13-1溶液的一般概念§13-2相律§13-3二元溶液的相图
本章基本知识点1.了解二元溶液的性质。2.了解二元溶液的相律。
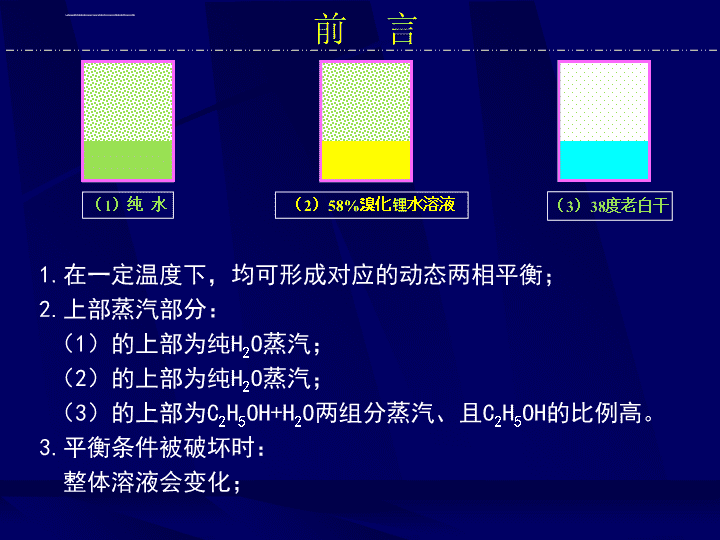
前言1.在一定温度下,均可形成对应的动态两相平衡;2.上部蒸汽部分:(1)的上部为纯H2O蒸汽;(2)的上部为纯H2O蒸汽;(3)的上部为C2H5OH+H2O两组分蒸汽、且C2H5OH的比例高。3.平衡条件被破坏时:整体溶液会变化;(1)纯水(2)58%溴化锂水溶液(3)38度老白干
前言H2O的蒸汽压、两相的C2H5OH+H2O组分的分压力也会变化;溶液的液相的浓度(成分)会变化。4.上部,H2O的压力或分压力不同;5.(3)的上部C2H5OH+H2O两组分的成分与液相中两组分成分一般不同;6.液相吸收蒸汽会放热,析出蒸汽需吸热。溶液热力学研究溶液的热力学性质及溶液在加热(或放热)过程中状态的变化情况。(1)纯水(2)58%溴化锂水溶液(3)38度老白干
13.1溶液的一般概念溶液1.溶液——由两种或两种以上的物质所组成的均匀、稳定的体系称为溶液。溶液分为:气态溶体,如空气;液体溶体,如溴化锂水溶液;固态溶体,又称固溶体。2.溶剂与溶质——在液态溶液(2)58%溴化锂水溶液中,能溶解其它物质的组分叫溶剂,被溶解的物质叫溶质。溶质可以是固体(如溴化锂)、液体(如乙醇)和气体(如氨气),溶剂一般为液体。3.溶液的“元”——“元”即表示组分多少的量词。二元溶液,如溴化锂-水溶液和氨-水溶液。一.溶液的浓度组成溶液的各组分在溶液中所占的百分比。常见的有:质量浓度、摩尔浓度。
13.1溶液的一般概念一.溶液的浓度以二元溶液为例1.质量浓度:式中:m1—溶液中组分1的质量(kg);m2—溶液中组分2的质量(kg);m—溶液的质量(kg)。2.摩尔浓度:式中:n1—第1种组分的摩尔数;n2—第i种组分的摩尔数;n—为溶液的总摩尔数。
13.2相律一.相体系内物理和化学性质完全均匀一致的部分称之为相。(2)58%溴化锂水溶液相与相之间有明显分界面。物质从一个相迁移到另一个相的过程称为相变。相平衡是多相系统中,宏观上没有任何物质在相间迁移的状态。(2)58%溴化锂水溶液二.相数相与相之间有明显分界面。体系内的相数用Φ表示。举例:空气,只有气相,Φ=1;湿饱和蒸汽,有液、汽两相,Φ=2。
13.2相律二.独立组分数平衡体系中独立存在的物质称为独立组分,其数目为独立组分数,用C表示。举例:冰水混合物,只有H2O一种组分,C=1;溴化锂水溶液,有LiBr和H2O,C=2。氧气湿饱和蒸汽三.自由度体系的自由度是指体系的独立可变因素。在一定范围内,这些因素的数值可以任意改变而不会引起相数的改变;用F表示。如:氧气,F=2,如p和t,在一定范围内这两个量(因素)可以自由改变,但p、t、v三个量不能同时自由改变。F=体系最小不可同时改变的状态参数的数目-1
四.相律相律是化学家吉布斯在1876年根据热力学理论推导出来的。相律是表述多相平衡系统自由度与相数、组分数以及影响系统性质的其他因素(T,p等)之间关系的规律。相律是相平衡的基本规律13.2相律溴化锂水溶液湿饱和蒸汽研究相律的任务是确定相平衡系统中的自由度数目。相律的数学表达式:①氧气:C=1,Φ=1,F=2;有两个独立可变的因素——p、t,p、v或t、v。不会是p、t、v三个都独立可变,F≠3。
四.相律②湿饱和蒸汽:C=1,Φ=2,F=1;只有一个独立可变因素——p,或t,或v。ps=1atm的湿蒸汽;ps=0.9atm的湿蒸汽;③单相溴化锂水溶液:C=2,Φ=1,F=3;p、t、ξ都是可以独立改变的因素。④溴化锂水溶液-蒸汽两相平衡时:C=2,Φ=2,F=2;t、ξ与上部的蒸汽压是相对应的。溴化锂水溶液湿饱和蒸汽13.2相律
四.相律溴化锂水溶液换一个角度,F是确定体系所处状态而需要的独立状态参数的数目。⑤单组分体系,C=1:当Φ=1时,F=2,如氧气;当Φ=2时,F=1,如湿蒸汽;稳定的大气,F=2。⑥两组分汽、液平衡体系:C=2,Φ=2,F=2确定处于汽、液平衡的二元溶液的状态,只需要知道两个独立的状态参数,其它状态参数就可随之而定。这两个状态参数可以是p、t、h和ξ中的任意两个参数。湿饱和蒸汽13.2相律
一.溶液的相平衡溴化锂水溶液溶液在一定条件下,易挥发的组分经常自发地通过分界面从液相转移到气相,因而造成了蒸汽压;同时也有一些气态基本微粒从气相转移到液相,这样:①气相、液相之间的转移产生了质量和能量的交换;②在转移过程中,当两种转移的速度相等时,在系统中所有各部分的全部状态参数都保持不变,实现溶液的相平衡状态。“所有各部分”即每一部分,如液相部分、气相部分;也包括整体系统;相平衡是动态平衡;溶液的相平衡与纯物质的相平衡有相同之处,又有一定的差别——二者都是动态平衡,但溶液的液相在相变时成分也同时发生变化。湿饱和蒸汽13.3二元溶液的相图
一.溶液的相平衡溴化锂水溶液溶液两相之间的质量与能量的交换:某一浓度的溶液,在不同的温度下形成对应不同蒸气压的相平衡;若溶液的液相被降温,则液相吸收上部蒸气;若压力较高的外部蒸气进入汽相中,则液相吸收上部蒸气;维持连续的吸气,则需要:①溶液降温,即取走热量;②浓度降到一定程度后的液相被抽走;③补充较高浓度的新溶液。湿饱和蒸汽单一组分的气、液两相之间质量与能量的连续交换:取热降温+凝液抽走。13.3二元溶液的相图
13.3二元溶液的相图二.理想溶液在一定的温度和压力下,溶液中任一种物质在任何浓度下均遵守拉乌尔定律的溶液称为理想溶液。理想溶液条件:①各组分在量上无论什么比例均彼此均匀相溶;②溶液中各种物质分子之间的相互吸引力完全相同,即容积分子之间,溶质分子之间及溶质分子与溶剂分子之间的相互吸引力完全相同;③两种溶剂相溶时无热效应;④在相溶过程中容积没有变化,即溶液的容积等于混合前各组分容积之和。三.拉乌尔定律1.拉乌尔定律:在一定温度下,理想溶液任一组分的蒸气分压等于其纯组分的饱和蒸气压乘以该组分在液相中的摩尔分数。式中:pi—组分i的蒸汽分压力;pi0—在相同温度下,组分i单独存在时的饱和蒸汽压力;xi—组分i在溶液中的摩尔浓度。
四.p-x图1.拉乌尔定律:对由组分A和组分B所组成的二元溶液来说,按照拉乌尔定律可得从整体看,又有A、B的摩尔分数。A、B组成理想溶液2.道尔顿分压力定律道尔顿分压力定律也讲蒸气分压,它指出:溶液中某一组分的蒸气分压等于溶液的饱和蒸气压乘以该组分在气相中的摩尔分数。13.3二元溶液的相图
在组分、温度确定的两相平衡态的溶液,四.p-x图A、B组成理想溶液3.p-x图①蒸气压p与x的曲线在组分、温度确定的两相平衡态的溶液,13.3二元溶液的相图App与xA成直线关系
即易挥发组分B在气相中的摩尔分数yB大于它在液相中的摩尔分数xB。A、B组成理想溶液3.p-x图②蒸气压p与y的曲线讨论B为溶液中易挥发组分时的情况:13.3二元溶液的相图
应当指出,大多数二元溶液不具有理想溶液的性质,实际溶液中各组分的蒸汽分压力,在应用拉乌尔定律时将产生偏差,但只要对理想溶液的公式作必要的修正,就可以应用于实际溶液了A、B组成理想溶液4.康诺瓦罗夫定律低沸点的液体在气相中的浓度必然大于在溶液里的浓度。这一关系式称为康诺瓦罗夫定律。13.3二元溶液的相图由前可知,易挥发组分B在气相中的摩尔分数yB大于它在液相中的摩尔分数xB。理想溶液的概念,不仅有理论价值,而且有实际意义。
本章结束!谢谢听讲!