- 2.90 MB
- 6页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
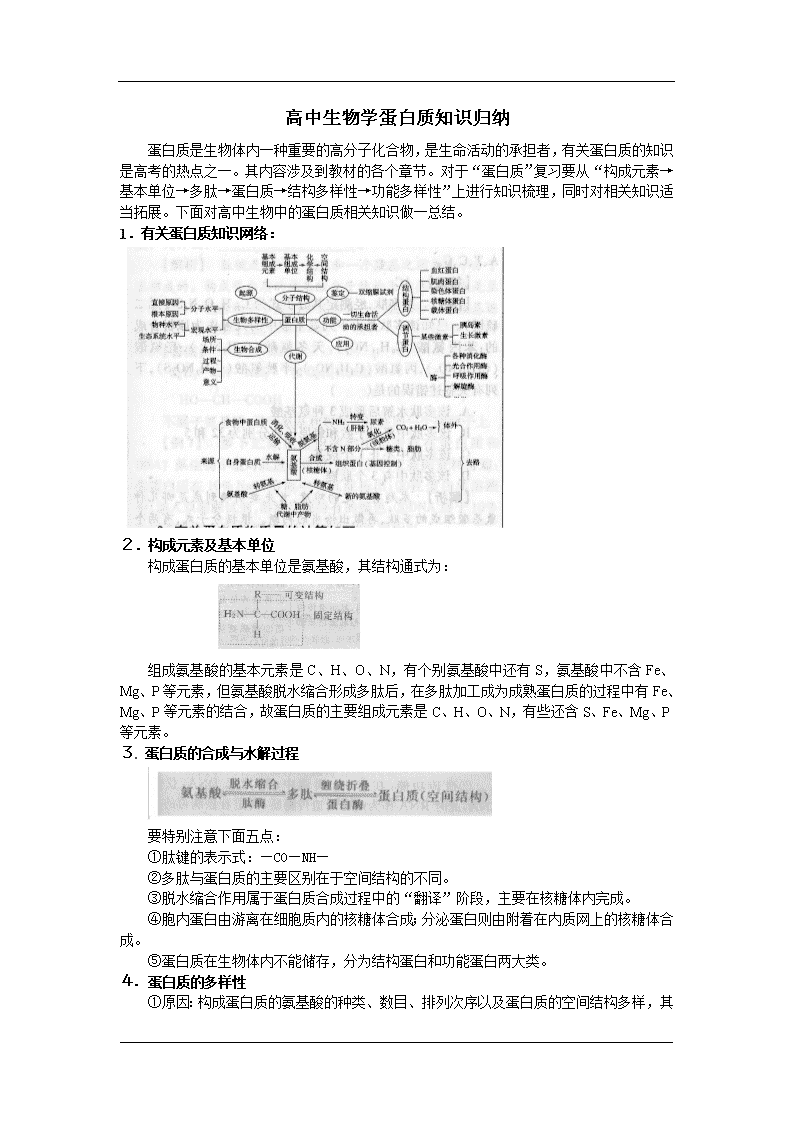
高中生物学蛋白质知识归纳蛋白质是生物体内一种重要的高分子化合物,是生命活动的承担者,有关蛋白质的知识是高考的热点之一。其内容涉及到教材的各个章节。对于“蛋白质”复习要从“构成元素→基本单位→多肽→蛋白质→结构多样性→功能多样性”上进行知识梳理,同时对相关知识适当拓展。下面对高中生物中的蛋白质相关知识做一总结。1.有关蛋白质知识网络:2.构成元素及基本单位构成蛋白质的基本单位是氨基酸,其结构通式为:组成氨基酸的基本元素是C、H、O、N,有个别氨基酸中还有S,氨基酸中不含Fe、Mg、P等元素,但氨基酸脱水缩合形成多肽后,在多肽加工成为成熟蛋白质的过程中有Fe、Mg、P等元素的结合,故蛋白质的主要组成元素是C、H、O、N,有些还含S、Fe、Mg、P等元素。3.蛋白质的合成与水解过程要特别注意下面五点:①肽键的表示式:—CO—NH—②多肽与蛋白质的主要区别在于空间结构的不同。③脱水缩合作用属于蛋白质合成过程中的“翻译”阶段,主要在核糖体内完成。④胞内蛋白由游离在细胞质内的核糖体合成;分泌蛋白则由附着在内质网上的核糖体合成。⑤蛋白质在生物体内不能储存,分为结构蛋白和功能蛋白两大类。4.蛋白质的多样性①
原因:构成蛋白质的氨基酸的种类、数目、排列次序以及蛋白质的空间结构多样,其中最主要的原因在于氨基酸的排列次序多样。②与DNA多样性、生物多样性的关系:5.蛋白质的鉴定对蛋白质的鉴定用的是双缩脲试剂。双缩脲试剂的组成成分中有A液(0.1g/mL的NaOH溶液)和B液(0.01g/mL的CuSO4溶液)。反应进行时应为碱性环境。双缩脲试剂的使用方法:先往要鉴定的蛋白质溶液(事先已经配好!)中加入0.1g/mL的NaOH溶液营造碱性环境,再使用0.01g/mL的CuSO4溶液,也就是说,双缩脲试剂A和双缩脲试剂B不能同时使用。双缩脲试剂的使用原理:双缩脲反应是指在碱性溶液中,双缩脲(H2NOC—NH—CONH2)能与Cu2+作用,形成紫色或紫红色络合物的化学反应。由于蛋白质分子中含有很多个与双缩脲结构相似的肽键,因此也发生了相似的颜色反应。用双缩脲试剂鉴定蛋白质时,起作用的是Cu2+。如果在NaOH溶液中滴几滴CuSO4溶液混合后再加入到蛋白质溶液中,混合液中就没有Cu2+(NaOH溶液与CuSO4溶液反应生成了Cu(OH)2),显色反应就不会发生。所以,双缩脲试剂A和双缩脲试剂B不能同时使用。6.有关蛋白质的计算:6.1 蛋白质形成过程中肽键、水分子计算由氨基酸分子脱水缩合可知,蛋白质形成过程中每形成一个肽键,同时失去一分子水,即形成的肽键数﹦失去水分子数。计算方法为:若有n个氨基酸分子构成有m条肽链的蛋白质,则形成的肽键数﹦失去水分子数﹦n—m。6.2 形成的蛋白质分子的相对分子质量假定每个氨基酸的相对分子质量为a,一个由n个氨基酸分子构成有m条肽链的蛋白质,其相对分子质量﹦(所有氨基酸分子的相对分子质量的总和)—(失去的水分子的相对分子质量总和)﹦na—(n—m)×18。这里要注意的是,我们有时还要考虑一些其他化学变化过程,如二硫键(一S—S一)形成等。6.3 氨基酸与相应DNA及RNA片段中碱基数目之间的关系如下:DNA(基因)→信使RNA→蛋白质碱基数6:碱基数3:氨基酸数1其中,对真核生物而言,上式中的DNA片段相当于基因结构中的外显子。6.4 有关蛋白质中游离的氨基或羧基数的计算A.至少含有的游离氨基或羧基数=肽链条数B.游离氨基或羧基数目=肽链条数+R基中含有的氨基或羧基数6.5 有关多肽种类的计算假若有A、B、C三种氨基酸,由这三中氨基酸组成多肽的情况可分为如下两种情况分析:A.A、B、C三种氨基酸,每种氨基酸数目无限的情况下,可形成肽类化合物的种类:形成三肽的种类:33=27种 形成二肽的种类:32=9种B.A、B、C三种氨基酸,且每种氨基酸只有一个的情况下,形成肽类化合物的种类:形成三肽的种类:3×2×1=6种 形成二肽的种类:3×2=6种7.蛋白质的功能
7.1 作为有机体新陈代谢的催化剂——酶。绝大部分的酶是蛋白质,有些酶除了蛋白质以外,还含有其他成分,如果这种成分能与酶蛋白共价结合的,称为辅基;如果这种成分与酶蛋白非共价结合的,称为辅酶。7.2 作为有机体的结构成分。在高等动物里,胶原纤维是主要的细胞外结构蛋白,参与结缔组织和骨骼作为身体的支架。细胞里的片层结构,如细胞膜、线粒体、叶绿体和内质网等的膜都是由不溶性蛋白和脂质组成的。7.3 某些蛋白质具有贮藏氨基酸的功能,用作有机体及其胚胎或幼体生长发育的原料。这类蛋白质有蛋类中的卵清蛋白、乳中的酪蛋白、小麦种子中的麦醇溶蛋白等。一般的动物体内,没有贮存蛋白。7.4 某些蛋白质具有运输的功能。脊椎动物红细胞里的血红蛋白和无脊椎动物中的血蓝蛋白在呼吸过程中起着输送氧气的作用。血液中的脂蛋白随着血流输送脂质。生物氧化过程中某色素蛋白如细胞色素C等起电子传递体的作用。7.5 有些蛋白质,如肌纤维中的肌球蛋白和肌动蛋白是肌肉收缩系统的主要成分。肌动蛋白可以和ATP相互作用而引起机械弹性的改变,伴随着肌原纤维收缩而产生运动的功能。细菌的鞭毛或纤毛蛋白也能产生类似的活动。近年来发现在非肌肉的运动系统中,普遍存在着运动蛋白。7.6 还有一些蛋白质具有激素的功能,对生物体内的新陈代谢起调节作用。如胰腺的胰岛B细胞分泌的胰岛素参与血糖的代谢调节,能降低血液中葡萄糖的含量;垂体分泌的生长激素能够促进动物体的生长发育等。7.7 某些蛋白质具有免疫功能。高等动物的免疫反应是有机体的一种防御机能。免疫反应主要是通过蛋白质——抗体来实现的。血浆中的γ球蛋白主要就是抗体。抗体是机体在外来抗原(大部分是外来蛋白质,也有多糖)的刺激下产生的,并能与抗原结合而排除外来物质对有机体的干扰。7.8 某些蛋白质在信息传递过程中起重要作用。如细胞膜上接受各种激素的受体蛋白,接受外界刺激的感觉蛋白(如视网膜上的视色素,味蕾上的味觉蛋白等)。7.9 蛋白质还有一个重要的功能是调节或控制细胞的生长、分化和遗传信息的表达。如组蛋白、阻遏蛋白等就是这种类型的蛋白质。 8.蛋白质的代谢蛋白质的代谢,可用下图表示:可联系的内容有:蛋白质的化学性消化过程及部位;氨基酸被吸收的方式、途径;蛋白质的中间代谢(在细胞内);蛋白质代谢与糖代谢、脂肪代谢之间的关系。8.1 糖类代谢与蛋白质代谢之间的相互联系丙酮酸是糖类代谢的重要中间产物。丙酮酸经过三羧酸循环可以变成a--酮戊二酸,丙酮酸也可以变成草酰乙酸,这三种酮酸可以经过加氨基或转氨基作用,分别变成丙氨酸、谷氨酸和天门冬氨酸这三种氨基酸。糖类还可以转变成其他非必需氨基酸,但是在人体内却不能合成必需氨基酸。
蛋白质是由氨基酸组成的,可以在人和动物的体内转变成糖类。如果用蛋白质饲养患糖尿病的狗,则有50%以上的食物蛋白质可以转变成葡萄糖。如果改用丙氨酸、谷氨酸、天门冬氨酸等饲养这种患人工糖尿病的狗,随尿排出的葡萄糖就会大大增加。用氨基酸饲养饥饿动物,根据狗肝脏中糖元量增加,也可以证明多种氨基酸在体内转变成了肝糖元。几乎所有组成蛋白质的天然氨基酸都可以转变成糖类。8.2 脂质代谢与蛋白质代谢之间的相互联系一般来说,在动物体内不能利用脂肪酸合成氨基酸。用只含蛋白质的食物饲养动物,动物也能够在体内存积脂肪。这个事实说明,蛋白质可以在动物体内转变成脂肪。9.自然界常见蛋白质的成分9.1大部分酶:酶是活细胞产生的一类具有生物催化作用的有机物,除少数的酶是RNA外,绝大多数的酶是蛋白质。9.2部分激素:如胰岛素、生长激素,其成分为蛋白质。9.3载体:位于细胞膜上,在物质运输过程中起作用,其成分为蛋白质。9.4抗体:指机体受抗原刺激后产生的,并且能与该抗原发生特异性结合的具有免疫功能的球蛋白。主要分布于血清中,也分布于组织液等细胞外液中。9.5抗毒素:属于抗体,成分为蛋白质。一般指用外毒素给动物注射后,在其血清中产生的能特异性中和外毒素毒性的成分。9.6凝集素:属于抗体,成分为蛋白质。指用细菌给动物注射后,在其血清中产生的能使细菌发生特异性凝集的成分。另外,人体红细胞膜上存在不同的凝集原,血清中则含有相应种类的凝集素。9.7部分抗原:引起机体产生抗体的物质叫抗原,某些抗原成分是蛋白质。如红细胞携带的凝集原、决定病毒抗原特异性的衣壳,其成分都是蛋白质。9.8神经递质的受体:突触后膜上存在的一些特殊蛋白质,能与一定的递质发生特异性的结合,从而改变突触后膜对离子的通透性,激起突触后膜神经元产生神经冲动或发生抑制。9.9朊病毒:近年来发现的,其成分为蛋白质,可导致疯牛病等。9.10糖被:位于细胞膜的外表面,由蛋白质和多糖组成,有保护、润滑、识别等作用。9.11单细胞蛋白:指通过发酵获得的大量微生物菌体。可用作饲料、食品添加剂、蛋白食品等。9.12丙种球蛋白:属于被动免疫生物制品。9.13细胞色素C:是动、植物细胞线粒体中普遍存在的一种呼吸色素,由一条大约含有110个氨基酸的多肽链组成。9.14血浆中的纤维蛋白原和凝血酶原:均为蛋白质。在疑血酶原激活物的作用下,凝血酶原转变成凝血酶,在凝血酶的作用下纤维蛋白原转变成不溶性纤维蛋白,起到止血和凝血作用。9.15血红蛋白:存在于红细胞中的含Fe2+的蛋白质。其特性是在氧浓度高的地方与氧结合,在氧浓度低的地方与氧分离。9.16肌红蛋白:存在于肌细胞中,为肌细胞储存氧气的蛋白质。9.17干扰素:由多种细胞产生的具有广泛的抗病毒、抗肿瘤和免疫调节作用的可溶性糖蛋白。正常情况下组织或血清中不含干扰素;只有在某些特定因素的作用下,才能使细胞产生干扰素。9.18动物细胞间质:主要含有胶原蛋白等成分,在进行动物细胞培养时,用胰蛋白酶处理才能获得单个细胞。9.19含蛋白质成分的实验材料:黄豆研磨液、豆浆、蛋清、蛋白胨、牛肉膏等。10.蛋白质与核酸比较
10.1两者均为生物体内的有机高分子化合物,相对分子量大10.2两者的胜、生理功能不同蛋白质是生命活动的主要承担者,是生物性状的体现者,据其功能分为:①结构蛋白:有些蛋白质是构成细胞和生物体的重要物质,如肌肉中蛋白质、生物膜中某些蛋白质、染色体中的蛋白质等。②功能蛋白:具有催化作用的酶;调节生命活动的某些激素(如垂体分泌的激素、胰岛分泌的激素等);具有免疫功能的抗体;具有运输功能的载体、血红蛋白。核酸是遗传信息的携带者,是生命活动的最终控制者。核酸对生物性状的控制是通过控制蛋白质合成实现的,核酸的基本功能为遗传信息的传递和表达。10.3两者的关系,核酸 控制合成 蛋白质。10.4两者均存在物种特异性,即不同物种具有不同的蛋白质和核酸,可从分子水平为生物进化、亲子鉴定、案件侦破等提供依据。10.5两者均由小分子形成蛋白质:氨基酸 缩合 多肽 蛋白质;核酸:核苷酸 聚合 多核苷酸链 核酸。10.6两者均存在多样性和特异性氨基酸的种类、数量、排列顺序,肽链的空间结构 决定 蛋白质的多样性;碱基排列顺序 决定 核酸的多样性核酸遗传的特异性决定了蛋白质的特异性。11. 高考生物蛋白质计算解题方法举例 11. 1 利用反应前后,“特殊原子的个数不变”计算例1.现有一种“十五肽”,分子式为CxHyNzOdSe(z>15,d>16)。已知其彻底水解后得到下列几种AA:问:将一个“十五肽”彻底水解,可生成______个半胱氨酸、______个天门冬氨酸和_____个赖氨酸。常规解法:根据反应前后各种原子个数不变,设天门冬氨酸、半胱氨酸、赖氨酸和苯丙氨酸的个数依次为m、n、o、p个,可得方程组:
解方程组,得各种氨基酸的个数(略)。特殊原子守恒法:依据特殊原子反应前后个数不变(本题中只有半胱氨酸含S原子,只有天门冬氨酸含两个—COOH、只有赖氨酸含有两个—NH2)进行计算。解法如下:⑴根据反应前后S原子守恒,S原子在脱水缩合时不消耗,可知“十五肽”中S原子个数即为半胱氨酸个数,即形成该多肽消耗了e个半胱氨酸;⑵设组成该多肽的天门冬氨酸为n个,可知:反应前氨基酸的O原子数=2×15(组成每分子多肽的氨基酸数)+2×n(天门冬氨酸数)反应后生成物中O原子数=d(多肽中O原子数)+14(脱下水中的O原子数)根据反应前后O原子守恒,可得:2×15+2×n=d+14→n=(d-16)/2⑶设组成该多肽的赖氨酸为m个,同⑵推理:只有赖氨酸含有两个氨基,反应前后N原子不会变化,由反应前后N原子守恒,可得:15+m=z→m=z-15答案:e(d-16)/2z-15点评:对于已知多肽中,求某种氨基酸的数目时,利用多肽形成前后某种“特殊”原子(如N、S、O)个数不变进行计算,可使复杂问题简单化。11. 2利用反应前后,“物质的量不变”计算例2.称取某多肽415g,在小肠液的作用下完全水解得到氨基酸505g。经分析知道组成该多肽的氨基酸平均相对分子质量为100。问该多肽是多少肽?解析:分析此题,可得如下等量关系:⑴多肽水解时消耗水的物质的量=多肽形成过程中脱下水的物质的量=[(505-415)/18]mol=5mol⑵若该多肽为n肽,已知氨基酸的平均相对分子质量为100,则:415g多肽的物质的量为:{415/[100n-(n-1)×18]}mol⑶多肽形成时脱下水的物质的量=多肽的物质的量×形成每分子多肽时脱水分子数={415/[100n-(n-1)×18]}×(n-1)=5求解,得:n=101答案:101点评:对已知多肽的质量及水解过程中的耗水量,求解组成每分子多肽的氨基酸数目时,利用反应前后水的物质的量不变可使解题思路清晰、化繁为简。