- 87.50 KB
- 7页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
实验一化学因素对微生物的影响二、基本原理常用化学消毒剂主要有重金属及其盐类、有机溶剂(酚、醇、醛等)、卤族元素及其化合物、染料和表面活性剂等。重金属离子可与菌体蛋白质结合而使之变性或与某些酶蛋白的巯基相结合而使酶失活,重金属盐则是蛋白质沉淀剂,或与代谢产物发生鳌合作用而使之变为无效化合物;有机溶剂可使蛋白质及核酸变性,也可破坏细胞膜透性使内含物外溢;碘可与蛋白质酪氨酸残基不可逆结合而使蛋白质失活,氯气与水发生反应产生的强氧化剂也具有杀菌作用;染料在低浓度条件下可抑制细菌生长,染料对细菌的作用具有选择性,革兰氏阳性菌普遍比革兰氏阴性菌对染料更加敏感;表面活性剂能降低溶液表面张力,这类物质作用于微生物细胞膜,改变其透性,同时也能使蛋白质发生变性。四、操作步骤l、将已灭菌并冷至50℃左右的牛肉膏蛋白胨琼脂培养基倒入无菌平血中,水平放置待凝固。2、用无菌吸管吸取0.2ml培养18h的金黄色葡萄球菌菌液加入到上述平板中,用无菌三角涂棒涂布均匀。3、将已涂布好的平板底皿划分成4~6等份,每一等份内标明一种消毒剂的名称。4、用无菌镊子将已灭菌的小圆滤纸片(D5mm)分别浸入装有各种消毒剂溶液的试管中浸湿。注意取出滤纸片时保证过滤纸片所含消毒剂溶液量基本一致,并在试管内壁沥去多余药液。无菌操作将滤纸片贴在平板相应区域,平板中间贴上浸有无菌生理盐水的滤纸片作为对照。5、将上述贴好滤纸片的含菌平板倒置放于37℃温室中,24h后取出观察抑(杀)菌圈的大小。实验二生物因素对微生物的影响二、基本原理生物之间的关系从总体上可分为互生、共生、寄生、拮抗等,微生物之间的拮抗现象是普遍存在于自然界的,许多微生物在其生命活动过程中能产生某种特殊代谢产物如抗生素,具有选择性地抑制或杀死其他微生物的作用,不同抗生素的抗菌谱是不同的,某些抗生素只对少数细菌有抗菌作用,例如青霉素一般只对革兰氏阳性菌具有抗菌作用,多粘菌素只对革兰氏阴性菌有作用,这类抗生素称为窄谱抗生素;另一些抗生素对多种细菌有作用,例如四环素、土霉素对许多革兰氏阳性菌和革兰氏阴性菌都有作用,称为广谱抗生素。本实验利用滤纸条法测定青霉素的抗菌谱,将浸润有青霉素溶液的滤纸条贴在豆芽汁葡萄糖琼脂培养基平板上,再与此滤纸条垂直划线接种试验菌,经培养后,根据抑菌带的长短,即可判断青霉素对不同类型微生物的影响,初步判断其抗菌谱。实验中所用试验菌通常以各种具有代表性的非致病菌来代替人体或动物致病菌,常用的试验菌株参见表2-1,而植物致病菌由于对人畜一般无直接危害,可直接用作试验菌。表2-1用于抗生素筛选的几种常用试验菌株实验菌株所代表的微生物类型金黄色葡萄球菌(Staphyloccusaureus)G+球菌枯草芽孢杆菌(Bacillussubtilis)G+杆菌大肠杆菌(Escherichiacoli)G-肠道菌草分枝杆菌(Mycobacteriumphlei)结核分枝杆菌酿酒酵母(Saccharomycescerevisiae)酵母状真菌白假丝酵母(Candidaalbicaus)酵母状真菌
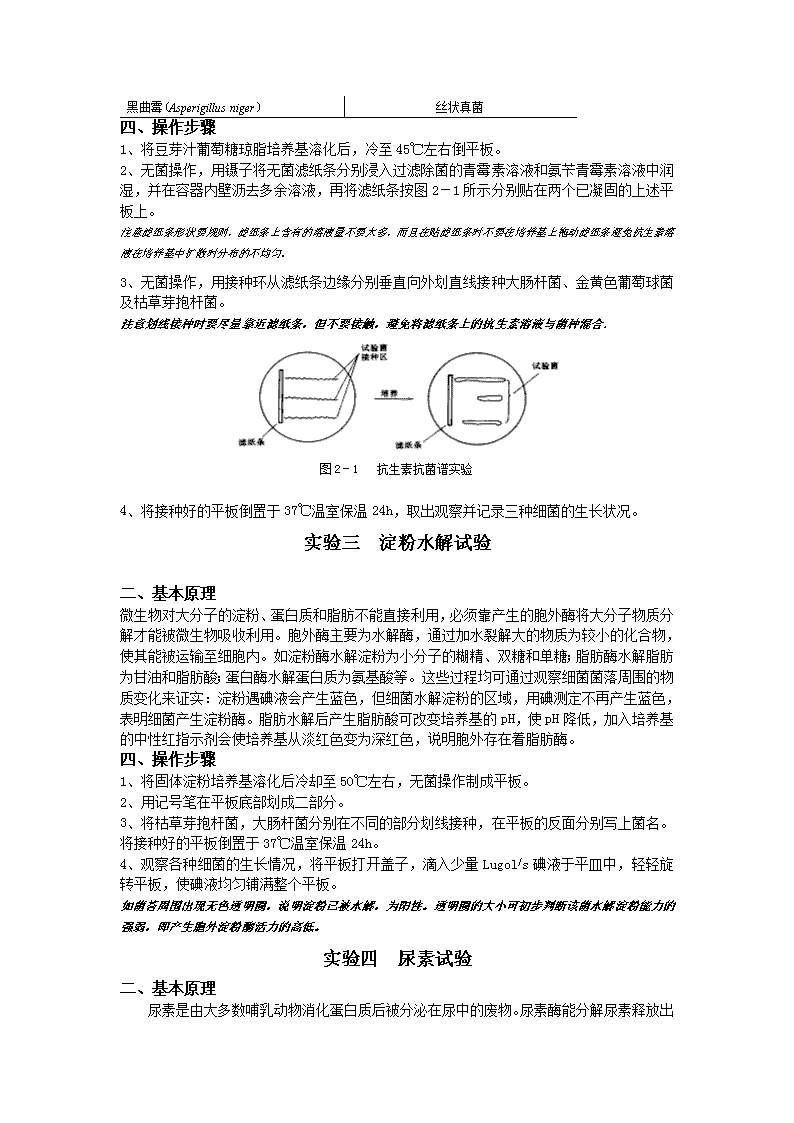
黑曲霉(Asperigillusniger)丝状真菌四、操作步骤1、将豆芽汁葡萄糖琼脂培养基溶化后,冷至45℃左右倒平板。2、无菌操作,用镊子将无菌滤纸条分别浸入过滤除菌的青霉素溶液和氨苄青霉素溶液中润湿,并在容器内壁沥去多余溶液,再将滤纸条按图2-1所示分别贴在两个已凝固的上述平板上。注意滤纸条形状要规则,滤纸条上含有的溶液量不要太多,而且在贴滤纸条时不要在培养基上拖动滤纸条避免抗生素溶液在培养基中扩散时分布的不均匀。3、无菌操作,用接种环从滤纸条边缘分别垂直向外划直线接种大肠杆菌、金黄色葡萄球菌及枯草芽抱杆菌。注意划线接种时要尽量靠近滤纸条,但不要接触,避免将滤纸条上的抗生素溶液与菌种混合.图2-1抗生素抗菌谱实验4、将接种好的平板倒置于37℃温室保温24h,取出观察并记录三种细菌的生长状况。实验三淀粉水解试验二、基本原理微生物对大分子的淀粉、蛋白质和脂肪不能直接利用,必须靠产生的胞外酶将大分子物质分解才能被微生物吸收利用。胞外酶主要为水解酶,通过加水裂解大的物质为较小的化合物,使其能被运输至细胞内。如淀粉酶水解淀粉为小分子的糊精、双糖和单糖;脂肪酶水解脂肪为甘油和脂肪酸;蛋白酶水解蛋白质为氨基酸等。这些过程均可通过观察细菌菌落周围的物质变化来证实:淀粉遇碘液会产生蓝色,但细菌水解淀粉的区域,用碘测定不再产生蓝色,表明细菌产生淀粉酶。脂肪水解后产生脂肪酸可改变培养基的pH,使pH降低,加入培养基的中性红指示剂会使培养基从淡红色变为深红色,说明胞外存在着脂肪酶。四、操作步骤1、将固体淀粉培养基溶化后冷却至50℃左右,无菌操作制成平板。2、用记号笔在平板底部划成二部分。3、将枯草芽抱杆菌,大肠杆菌分别在不同的部分划线接种,在平板的反面分别写上菌名。将接种好的平板倒置于37℃温室保温24h。4、观察各种细菌的生长情况,将平板打开盖子,滴入少量Lugol/s碘液于平皿中,轻轻旋转平板,使碘液均匀铺满整个平板。如菌苔周围出现无色透明圈,说明淀粉已被水解,为阳性。透明圈的大小可初步判断该菌水解淀粉能力的强弱,即产生胞外淀粉酶活力的高低。实验四尿素试验二、基本原理
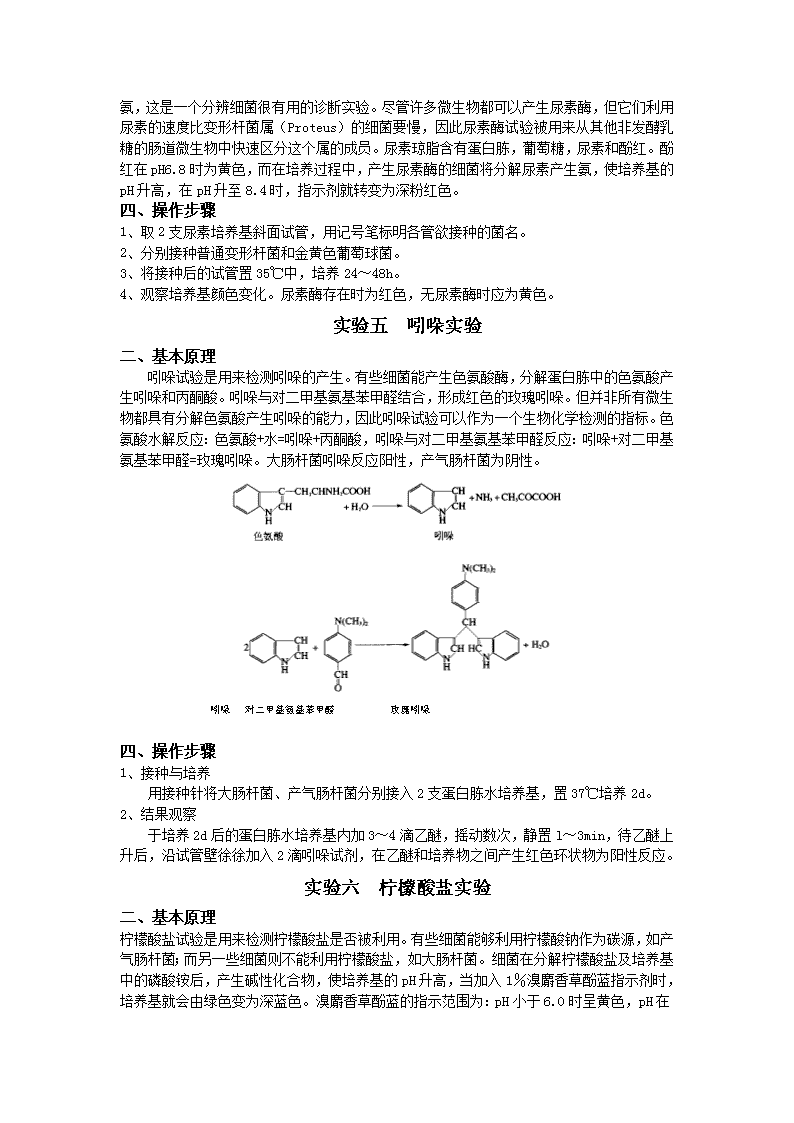
尿素是由大多数哺乳动物消化蛋白质后被分泌在尿中的废物。尿素酶能分解尿素释放出氨,这是一个分辨细菌很有用的诊断实验。尽管许多微生物都可以产生尿素酶,但它们利用尿素的速度比变形杆菌属(Proteus)的细菌要慢,因此尿素酶试验被用来从其他非发酵乳糖的肠道微生物中快速区分这个属的成员。尿素琼脂含有蛋白胨,葡萄糖,尿素和酚红。酚红在pH6.8时为黄色,而在培养过程中,产生尿素酶的细菌将分解尿素产生氨,使培养基的pH升高,在pH升至8.4时,指示剂就转变为深粉红色。四、操作步骤1、取2支尿素培养基斜面试管,用记号笔标明各管欲接种的菌名。2、分别接种普通变形杆菌和金黄色葡萄球菌。3、将接种后的试管置35℃中,培养24~48h。4、观察培养基颜色变化。尿素酶存在时为红色,无尿素酶时应为黄色。实验五吲哚实验二、基本原理吲哚试验是用来检测吲哚的产生。有些细菌能产生色氨酸酶,分解蛋白胨中的色氨酸产生吲哚和丙酮酸。吲哚与对二甲基氨基苯甲醛结合,形成红色的玫瑰吲哚。但并非所有微生物都具有分解色氨酸产生吲哚的能力,因此吲哚试验可以作为一个生物化学检测的指标。色氨酸水解反应:色氨酸+水=吲哚+丙酮酸,吲哚与对二甲基氨基苯甲醛反应:吲哚+对二甲基氨基苯甲醛=玫瑰吲哚。大肠杆菌吲哚反应阳性,产气肠杆菌为阴性。吲哚对二甲基氨基苯甲醛玫瑰吲哚四、操作步骤1、接种与培养用接种针将大肠杆菌、产气肠杆菌分别接入2支蛋白胨水培养基,置37℃培养2d。2、结果观察于培养2d后的蛋白胨水培养基内加3~4滴乙醚,摇动数次,静置l~3min,待乙醚上升后,沿试管壁徐徐加入2滴吲哚试剂,在乙醚和培养物之间产生红色环状物为阳性反应。实验六柠檬酸盐实验二、基本原理
柠檬酸盐试验是用来检测柠檬酸盐是否被利用。有些细菌能够利用柠檬酸钠作为碳源,如产气肠杆菌;而另一些细菌则不能利用柠檬酸盐,如大肠杆菌。细菌在分解柠檬酸盐及培养基中的磷酸铵后,产生碱性化合物,使培养基的pH升高,当加入1%溴麝香草酚蓝指示剂时,培养基就会由绿色变为深蓝色。溴麝香草酚蓝的指示范围为:pH小于6.0时呈黄色,pH在6.0~7.0时为一绿色,pH大于7.6时呈蓝色。四、操作步骤1、接种与培养用接种针将大肠杆菌、产气肠杆菌分别接入2支柠檬酸盐斜面培养基,置37℃培养2d。2、结果观察培养48h后观察柠檬酸盐斜面培养基上有无细菌生长和是否变色。蓝色为阳性,绿色为阴性。实验七硫化氢实验二、基本原理硫化氢试验是检测硫化氢的产生,也是用于肠道细菌检查的常用生化试验。有些细菌能分解含硫的有机物,如胱氨酸、半胱氨酸、甲硫氨酸等产生硫化氢,硫化氢一遇培养基中的铅盐或铁盐等,就形成黑色的硫化铅或硫化铁沉淀物。大肠杆菌反应为阴性,产气肠杆菌为阳性。CH2SHCHNH2COOH+H2O→CH3COCOOH+NH3+H2SH2S+Pb(CH3COO)2→PbS↓+2CH3COOHH2S+FeSO4→FeS↓+H2SO4四、操作步骤1、用接种针将大肠杆菌、产气肠杆菌分别穿刺接入2支柠檬酸铁铵培养基中置37℃培养48h。2、结果与观察培养48h后观察黑色硫化铅产生。实验八糖发酵试验二、基本原理糖发酵试验是常用的鉴别微生物的生化反应,在肠道细菌的鉴定上尤为重要。绝大多数细菌都能利用糖类作为碳源和能源,但是它们在分解糖类物质的能力上有很大的差异。有些细菌能分解某种糖产生有机酸(如乳酸、醋酸、丙酸等)和气体(如氢气、甲烷、二氧化碳等);有些细菌只产酸不产气。例如大肠杆菌能分解乳糖和葡萄糖产酸并产气;伤寒杆菌分解葡萄糖产酸不产气,不能分解乳糖;发酵培图8-1糖发酵实验A.培养前的情况B.培养后产酸不产气C.培养后产酸产气养基含有蛋白胨,指示剂(溴甲酚紫),倒置的德汉氏小管和不同的糖类。当发酵产酸时,溴甲酚紫指示剂可由紫色(PH6.8)变为黄色(PH5.2)。气体的产生可由倒置的德汉氏小管中有无气泡来证明。四、操作步骤1、用记号笔在各试管外壁上分别标明发酵培养基名称和所接种细菌菌名。2、取葡萄糖发酵培养基试管3支,分别接人大肠杆菌,产气肠杆菌,第三支不接种,作为对照。另取乳糖发酵培养基试管3支,同样分别接入大肠杆菌,产气肠杆菌,第三支不接种,作为对照。在接种后,轻缓摇动试管,使其均匀,防止倒置的小管进入气泡.3、将接种过和作为对照的6支试管均置37℃培养24~48h。4、观察各试管颜色变化及德汉氏小管中有无气泡。
实验九甲基红实验二、基本原理甲基红试验是用来检测由葡萄糖产生的有机酸,如甲酸、乙酸、乳酸等。当细菌代谢糖产生酸时,培养基就会变酸,使加入培养基的甲基红指示剂由橘黄色(pH6.3)变为红色(pH4.2),即甲基红反应。尽管所有的肠道微生物都能发酵葡萄糖产生有机酸,但这个试验在区分大肠杆菌和产气肠杆菌上仍然是有价值的。这两个细菌在培养的早期均产生有机酸,但大肠杆菌在培养后期仍能维持酸性pH4,而产气肠杆菌则转化有机酸为非酸性末端产物,如乙醇、丙酮酸等,使pH升至大约6。因此,大肠杆菌为阳性反应,产气肠杆菌为阴性反应。四、操作步骤1、接种与培养用接种针将大肠杆菌、产气肠杆菌分别接入2支葡萄糖蛋白胨水培养基,置37℃培养2d。2、结果观察培养2d后,将1支葡萄糖蛋白胨水培养物内加人甲基红试剂2滴,培养基变为红色者为阳性,变黄色者为阴性。注意甲基红试剂不要加得太多,以免出现假阳性反应。实验十伏-普试验二、基本原理伏-普试验是用来测定某些细菌利用葡萄糖产生非酸性或中性末端产物的能力,如丙酮酸。丙酮酸进行缩合、脱羧生成乙酰甲基甲醇,此化合物在碱性条件下能被空气中的氧气氧化成二乙酰。二乙酰与蛋白胨中精氨酸的胍基作用,生成红色化合物,即伏-普反应阳性;不产生红色化和物者为阴性反应。大肠杆菌为阴性反应,产气肠杆菌为阳性反应。有时为了使反应更为明显,可加入少量含胍基的化合物,如肌酸等。四、操作步骤接种与培养:将大肠杆菌、产气肠杆菌分别接种于两支葡萄糖蛋白胨水培养基,37℃培养两天,在培养液中加入40%的KOH5~10滴,然后加入等量的5%α—萘酚溶液,用力振荡,再放入37℃温箱中保温15~30分钟,若培养物呈红色为伏一普反应阳性。实验十一用生长谱法测定微生物的营养要来二、基本原理
微生物的生长繁殖需要适宜的营养环境,碳源、氮源、无机盐、微量元素、生长因子等都是微生物生长所必需,缺少其中一种,微生物便不能正常生长、繁殖。在实验室条件下,人们常用人工配制的培养基来培养微生物,这些培养基中含有微生物生长所需的各种营养成分。如果人工配制一种缺乏某种营养物质(例如碳源)的琼脂培养基,接人菌种混合均匀后倒平板,再将所缺乏的营养物质(各种碳源)点植于平板上,在适宜的条件下培养后,如果接种的这种微生物能够利用某种碳源,就会在点植的该种碳源物质周围生长繁殖,呈现出由许多小菌落组成圆形区域(菌落圈),而该微生物不能利用的碳源周围就不会有微生物的生长,最终在平板上呈现一定的生长图形。由于不同类型微生物利用不同营养物质的能力不同,它们在点植有不同营养物质的平板上的生长图形就会有差别,具有不同的生长谱,故称此法为生长谱法。该法可以定性、定量地测定微生物对各种营养物质的需求,在微生物育种、营养缺陷型鉴定以及饮食制品质量检测等诸多方面具有重要用途。四、操作步骤1、将培养24h的大肠杆菌斜面用无菌生理盐水洗下,制成菌悬液。2、将合成培养基溶化并冷却至50℃左右,加入上述菌液并混匀,倒平板。3、在两个已凝固的平板皿底用记号笔分别划分成三个区域,并标明要点植的各种糖,如下页图示。4、用6根无菌牙签分别挑取6种糖对号点植。注意点值时糖要集中,取糖量为小米粒大小即可,图11-1生长谱法测糖过多时,溶化后糖溶液扩散区域过大会导致不同的糖定大肠杆菌碳源要求相互混合。5、待糖粒溶化后再将平板倒置于37℃温室保温18~24h观察各种糖周围有无菌落圈。注意点植糖后不要匆忙将平板倒置,否则尚未溶化的糖粒会掉到皿盖上。实验十二比浊法测定微生物生长二、基本原理在科学研究和生产过程中,为及时了解培养过程中微生物的生长情况,需定时测定培养液中微生物的数量,以便适时地控制培养条件,获得最佳的培养物。比浊法是常用的测定方法。比浊法是在浊度计或比色计上进行测定培养液中微生物的数量。某一波长的光线,通过混浊的液体后,其光强度将被减弱。人射光与透过光的强度比与样品液的浊度和液体的厚度相关。如果样品液层厚度一定,则OD值与样品的浊度相关,根据此原理,可通过测定样品中的OD值来代表培养液中的浊度即微生物量。也可同时做平板计数法,对比一定混浊度所含活菌数制成曲线。本法测定的是微生物的总量。适用于菌体分散良好的非丝状单细胞微生物的测定。在进行大量培养时,此法比平板计数法能较快得出结果,省时省力。四、实验内容1、把比色计的波长调整到600nrn,开机预热10~15min2、在比色杯中盛未接种的培养液进行零点调整。3、将培养8h和14h的大肠杆菌菌液分别倒入相同类型的比色杯中,测定其OD值。若菌液浓度大,可适当进行稀释,使OD值的读数在0~0.4之间最好。4、测定后把比色杯中的菌液倾入容器中,用水冲洗比色杯,冲洗水也收集于容器中进行灭菌。最后用70%酒精冲洗比色杯。实验十三微生物原生质体的制备二、基本原理
原核微生物基因重组主要可通过转化、转导、接合等途径,但有些微生物不适于采用这些途径,从而使育种工作受到一定的限制。1978年第三届国际工业微生物遗传学讨论会上,有人提出微生物细胞原生质体融合这一新的基因重组手段。由于它具有许多特殊优点,所以,目前已为国内外微生物育种工作所广泛研究和应用。而原生质体融合技术首先要求制备原生质体。原生质体的制备主要是用酶解除去细胞壁,不同的微生物细胞由于细胞壁的结构不同要求采用不同的酶解方法来进行处理。常用的酶包括溶菌酶、纤维素酶、蜗牛酶等。四、操作步骤1、培养酵母菌取菌株新鲜斜面接一环到装有YPD的250ml锥形瓶中,28℃,150rpm振荡培养16h,使细胞生长进入对数期。2、收集细胞取菌液5ml,3000r/min离心10min,弃上清液,将菌体悬浮于缓冲液中,离心。如此洗涤两次,将菌体悬浮于5ml缓冲液中,每ml约含107~108活菌为宜。3、总菌数测定取菌液0.5ml,用生理盐水稀释,取10-4、10-5、10-6各lml(每稀释度作两个平板)、倾注YPD培养基,30℃培养48h后计数。此为未经酶处理的总菌数。4、脱壁取3ml菌悬液,加入3ml蜗牛酶溶液,混匀后在30℃水浴保温处理30min,定时取样,镜检观察原生质体形成情况,当95%以上细胞变成球状原生质体时,用3000r/min离心10min,弃上清液,用缓冲液洗涤除酶,然后将原生质体悬浮于3ml缓冲液中。立即进行剩余菌数的测定。5、剩余菌数测定取0.5ml上述原生质体悬液,用无菌水稀释,使原生质体裂解死亡,取10-2、10-3、10-4稀释液各0.lml,涂布于YPD培养基平板上,30℃培养48h,生长出的菌落应是未被酶裂解的剩余细胞。计算酶处理后剩余细胞数,并计算原生质体形成率。原生质体形成率=(未经酶处理的总菌数—酶处理后剩余细胞数)/总菌数