- 415.50 KB
- 11页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
木质素生物降解的最新研究进展*四川省科技支撑计划资助项目(NO.09GG1632)潘明凤:女,1988年出生,硕士研究生周祚万:通讯作者Tel.:02887600454E-mail:zwzhou@at-c.net潘明凤a姜曼b周祚万ba西南交通大学生命科学与工程学院成都610031b材料先进技术教育部重点实验室,西南交通大学材料科学与工程学院成都610031摘要木质素广泛存在于几乎所有的植物类生物质材料中,利用微生物降解木质素不仅可以缓解环境污染,还可以变废为宝,实现资源的循环利用。本文对降解木质素的微生物种类、木质素降解酶的理化性质和作用机理、营养调控等方面的研究进展进行了综述,以期为木质素生物降解法的深入研究提供参考。关键词木质素生物降解木质素降解酶营养调控ThenearestresearchadvancesinBiodegradationofLigninPanMingfenga,JiangManb,ZhouZuowanb(aCollegeofLifeScieneeandEngineering,SouthwestJiaotongUniversity,Chengdu610031;bKeyLaboratoryofAdvancedMaterialsTechnology,MinistryofEducation,Chengdu610031;CollegeofMaterialsScienceandEngineering,SouthwestJiaotongUniversity,Chengdu610031)AbstractLignin,aresistantcell-wallconstituentofallvascularplants,isthesecondmostabundantorganicsubstanceonearth.Biodegradationoflignincouldnotonlyalleviatepollutionbutalsocanturn“waste”intowealthaswellasrealizeresourcerecycling.Researchadvancesinbiodegradationoflignin,including:microorganisms,physicalandchemicalcharacteristicsofthelignin-degradingenzymes,degradationmechanismandthenutritionregulationshavebeenreviewedinthispaperforpurposeofdevelopmentandapplicationofligninbiodegradation.Keywordslignin;Biodegradation;Lignin-degradingenzymes;nutritionregulations0前言木质素广泛存在于几乎所有的植物类生物质材料中,是植物细胞壁的重要组成部分,在自然界中的产量仅次于纤维素是一种极具潜力的可再生资源[1,2]。同时,其分子量大、结构复杂,自然降解速度缓慢,成为地球生物圈中碳循环的主要障碍之一。木质素是由苯丙烷单元通过醚键和碳碳键连接而成的聚酚类三维网状高分子化合物,研究证实共有三种基本结构单元(非缩合型结构),即愈创木基结构、紫丁香基结构和对羟苯基结构。从20世纪开始,国内外学者一直在寻找降解木质纤维素的最佳途径,涉及的研究主要包括[3]:物理法、化学法、物理化学法、生物降解法。而利用微生物降解木质素不仅可以缓解环境污染,还可以变废为宝,实现资源再利用,已引起了国内外学者的关注[4-7]11
。鉴于可再生资源循环利用的重大现实意义,我们就微生物降解木质素的最新研究进展进行综述,特别关注了降解木质素的微生物种类、木质素降解酶系的理化性质和作用机理、木质素降解酶的活性调控等热点学术问题。1可降解木质素的微生物种类自然界中,木质素的完全降解是真菌、细菌、放线菌及相应微生物群落共同作用的结果,其中真菌起着主导作用,放线菌降解能力次之,细菌降解能力最弱。降解木质素的真菌主要分为三类:白腐菌、褐腐菌、软腐菌。其中白腐真菌的降解能力最强,并且分泌胞外酶对木质素降解过程中不会产生色素,开发利用前景较好,被认为是目前最为理想的一类降解木质素的真菌[8,9]。其主要分布在革盖菌属(Coriolus)、烟管菌属(Sjekandera)、平革菌属(Phanerochaete)、侧耳属(Pleurotus)及卧孔菌属(Poria)等[10]。目前,用于木质素降解研究的白腐菌主要有黄孢原毛平革菌(Phanerochetechrysosporium)[11,12]、杂色云芝(Coridusversicolor)[13-15]、平菇(Pleurotusostreatus)[13]、变色栓菌(Thametesversicolor)、朱红密孔菌(Pycnoporuscinnabarinus)等,其中黄孢原毛平革菌是研究最透彻的模式菌[16-18]。降解木质素的细菌主要有厌氧梭菌(Clostridiumsp.)、不动杆菌(Acinetobacter)、黄杆菌属(Flavobact-erium)、微球菌属(Micrococcus)、假单胞菌属(Pseudomonas)、双芽孢杆菌属(Amphibacillus)、黄单胞菌属(Xanthomonas)、枝动杆菌属(Mycoplana),还有粘膜炎布兰汉氏球菌(Branhamellacatarrhalis)、环丝菌(Brochothrix)、坚强芽孢杆菌(Bacillusfirmus),其中假单胞菌属是最有效的降解菌[19,20]。细菌在初级代谢阶段降解木质素,在生长的对数期和稳定期合成木质素降解酶[21]。细菌在降解过程中主要是使木质素一定程度上发生变性,成为水溶性的聚合物,很少将木质素矿化为CO2。另外,细菌在木质素降解过程中主要起着间接的作用,即细菌与真菌协同作用使木质素易于受到真菌的攻击,且可去除对腐朽真菌有毒性的物质[19]。放线菌类是公认降解能力较强的细菌,降解木质素的放线菌主要有链霉菌属(Streptomyces)[22,23]、高温放线菌属(Thermoactinomyces)、节杆菌属(Arthrobacter)、小单孢菌属(Micromonospora)、诺卡氏菌属(Nocardia)和褐色高温单胞菌(Thermonosporafusca)。TuomelaM等[20]研究表明,链霉菌属的丝状细菌降解木质素最高可达20%,在木质素降解中起主要作用。近年来的研究也发现了一些非常规降解菌种,如张金萍等[24]发现的灵芝属某些菌种对木质素都有较好的降解能力。RCBonugli-Santos[25]研究发现三株海洋真菌在不同碳源及盐浓度下可以产生不同酶活力的木质素酶,其中M.racemosu-sCBMAI847产生的LiP、MnP、Lac的酶活力最高值分别达75376.34、4484.30、898.15U·L−1。关于土壤低等真菌降解木质素的研究报道也时有出现,主要有产黄青霉(Penicilliumchrysogenum)、镰刀霉(Fusariumproliferatum)、简青霉(Penicilliumsimplicissimum)等[26]。2木质素微生物降解酶系的理化性质及作用机理11
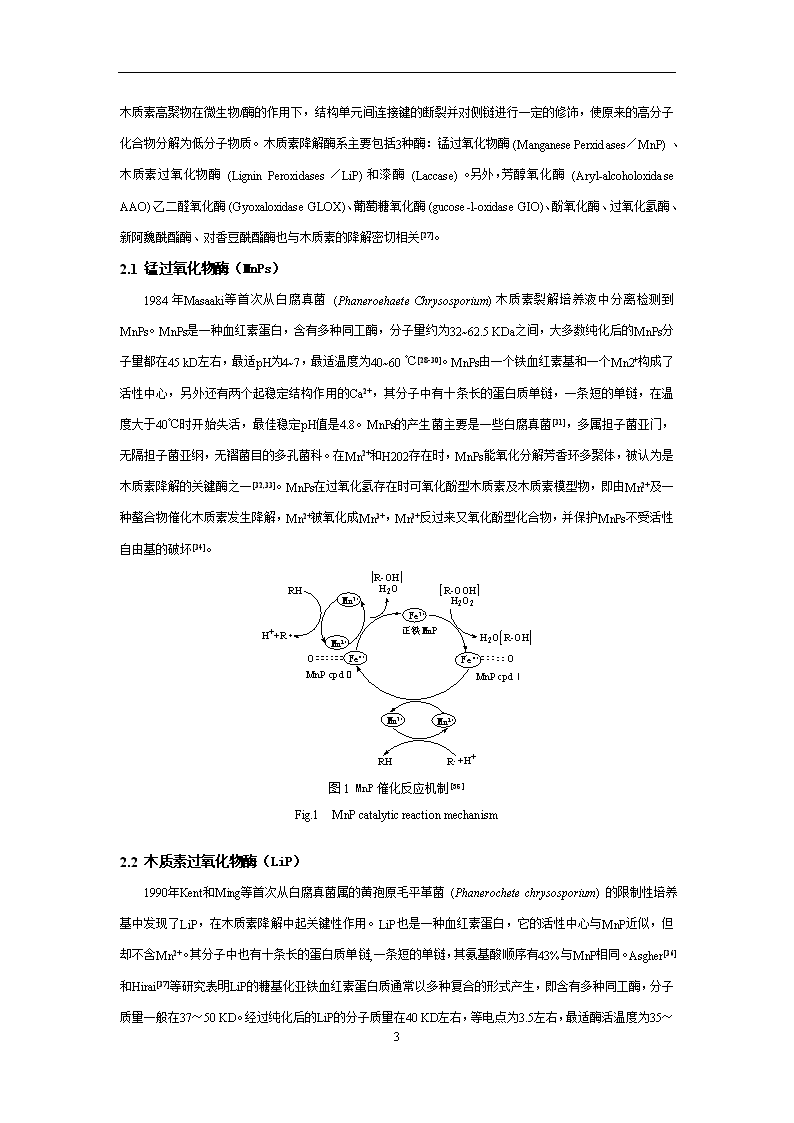
木质素的微生物降解过程中发生的主要化学变化有侧链氧化、去甲基化、去甲氧基化、芳环开环等。木质素高聚物在微生物/酶的作用下,结构单元间连接键的断裂并对侧链进行一定的修饰,使原来的高分子化合物分解为低分子物质。木质素降解酶系主要包括3种酶:锰过氧化物酶(ManganesePerxidases/MnP)、木质素过氧化物酶(LigninPeroxidases/LiP)和漆酶(Laccase)。另外,芳醇氧化酶(Aryl-alcoholoxidaseAAO)、乙二醛氧化酶(GyoxaloxidaseGLOX)、葡萄糖氧化酶(gucose-l-oxidaseGIO)、酚氧化酶、过氧化氢酶、新阿魏酰酯酶、对香豆酰酯酶也与木质素的降解密切相关[27]。2.1锰过氧化物酶(MnPs)1984年Masaaki等首次从白腐真菌(PhaneroehaeteChrysosporium)木质素裂解培养液中分离检测到MnPs。MnPs是一种血红素蛋白,含有多种同工酶,分子量约为32~62.5KDa之间,大多数纯化后的MnPs分子量都在45kD左右,最适pH为4~7,最适温度为40~60℃[28-30]。MnPs由一个铁血红素基和一个Mn2+构成了活性中心,另外还有两个起稳定结构作用的Ca2+,其分子中有十条长的蛋白质单链,一条短的单链,在温度大于40℃时开始失活,最佳稳定pH值是4.8。MnPs的产生菌主要是一些白腐真菌[31],多属担子菌亚门,无隔担子菌亚纲,无褶菌目的多孔菌科。在Mn2+和H202存在时,MnPs能氧化分解芳香环多聚体,被认为是木质素降解的关键酶之一[32,33]。MnPs在过氧化氢存在时可氧化酚型木质素及木质素模型物,即由Mn2+及一种螯合物催化木质素发生降解,Mn2+被氧化成Mn3+,Mn3+反过来又氧化酚型化合物,并保护MnPs不受活性自由基的破坏[34]。图1MnP催化反应机制[35]Fig.1MnPcatalyticreactionmechanism2.2木质素过氧化物酶(LiP)1990年Kent和Ming等首次从白腐真菌属的黄孢原毛平革菌(Phanerochetechrysosporium)的限制性培养基中发现了LiP,在木质素降解中起关键性作用。LiP也是一种血红素蛋白,它的活性中心与MnP近似,但却不含Mn2+。其分子中也有十条长的蛋白质单链,一条短的单链,其氨基酸顺序有43%与MnP相同。Asgher[36]和Hirai[37]等研究表明LiP的糖基化亚铁血红素蛋白质通常以多种复合的形式产生,即含有多种同工酶,分子质量一般在37~50KD。经过纯化后的LiP的分子质量在40KD左右,等电点为3.5左右,最适酶活温度为35~11
55℃,最适pH为2.0~5.0[30,38,39]。LiP氧化还原电位为1.5V,在H202存在时,LiP能氧化分解芳香环多聚体,通过催化木质素侧链的Cα一Cβ链使其断裂从而降解木质素,被认为是木质素降解的关键酶之一。LiP的产生菌在自然界分布相当广泛,许多腐朽木材的白腐菌、褐腐菌都可以产生。LiP能催化木质素中富含电子的酚型或非酚型芳香化合物发生氧化,产生活性基团,然后发生一系列的非酶促裂解反应,实现对底物的部分氧化或彻底的氧化[40],具体反应机制如下[41]:图2LiP的催化循环Fig.2CatalyticcycleofLiPLiP化合物I携带H202的两个氧化当量,一个为Fe4+-O中心,另一个形成卟啉的阳离子自由基。基质R被化合物I氧化成芳基阳离子自由基,然后通过一系列的非酶反应生成最终的产物。2.3漆酶(Lac)1883年,日本学者Yoshi首次从日本紫胶漆树(Rhusvemieittua)漆液中发现一种可催化漆固化过程的蛋白质,1895年,Bertrand将这种蛋白质命名为漆酶(Laccase),随后人们研究发现它广泛存在于植物、昆虫和高等真菌中,甚至一些动物肾脏(如猪肾)和血清中也发现了漆酶。漆酶按其来源主要分为漆树漆酶(RhusLaccase)和真菌漆酶(FungalLaccase)两大类。在真菌中,漆酶广泛存在于担子菌(Baidimycetes)、多孔菌(Polyporus)、子囊菌(Asomycetes)、脉孢菌(Neurospora)和柄孢壳菌(Podospora)等中。有文献[42]报道,单独培养黄孢原毛平革菌(P.chrysosporium)很难检测到漆酶活性。Lac是一种含铜的多酚氧化酶,属蓝色多铜氧化酶家族,由肽链、糖配基和cu2+三部分组成,肽链一般由500~550个氨基酸组成,糖配基主要包括氨基己糖、葡萄糖、甘露糖、半乳糖、岩藻糖和阿拉伯糖,其分子量在58~90KDa之间[43,44]。对于不同白腐真菌,漆酶的最适pH变化范围为2~10,最适的温度范围为40~65℃[43-46]。同一漆酶对不同底物作用时,最适作用pH也有差异[47]。迄今已有较耐高温真菌漆酶的报道,Marasmiumquercophilus所产漆酶在75℃条件下半衰期为10min[48]。漆酶催化反应不需要过氧化氢参与,一般认为漆酶催化反应是木质素降解的启动步骤[49]。漆酶可在仅有碳源存在的条件下由菌体分泌,并且具有780mV氧化还原电位,在没有H202和其他次级代谢产物的存在下可催化有机污染物的氧化[42]11
。Lac所催化的主要是氧化反应,表现在底物自由基的生成和4个铜离子的协同作用,主要攻击木质素中的苯酚结构单元,在反应中,苯酚被氧化产生含苯氧基自由基的活性基团,可导致芳香基的裂解。Lac同时具有催化解聚和聚合木质素的作用,因此单独存在时不能降解木质素,只有同时存在MnP等其他酶,避免反应产物重新聚合时,才有较高的木质素降解效率。对其作用机理,目前比较广泛接受的是其催化多酚化物如氢醌,此过程须经过四次单电子传递。首先,底物氢醌向漆酶转移一个电子生成半醌-氧自由基中间体,而后两分子半醌生成一分子氢醌和一分子苯醌,氧自由基中间体还能转变成碳自由基中间体,它们可以相互结合或相互偶联。因此,在菌体内,漆酶与其它氧化木质素酶系协同降解木质素。在体外实验中,木质素单体在Laccase/O2条件下会发生聚合反应。O2存在条件下,还原态漆酶被氧化,O2被还原成水,漆酶催化底物氧化和对02的还原实现过程可用下式表示[50]:图3Lac的催化作用过程Fig.3CatalyticactionprocessofLac2.4白腐真菌木质素降解酶系的降解机理白腐真菌以其独特的生理生化机制和强大的降解代谢能力而成为木质素降解研究的模式菌株,是已知的唯一能在纯系培养中有效地将木质素降解为CO2和H2O的一类微生物[51]。近年来,有研究报道白腐菌对木质素的降解主要依靠特殊的胞外水解酶和氧化酶的作用[52-57]。白腐菌对木质素的降解过程复杂,但至少存在三种方式的降解反应[56]:(1)丙烷基侧链Cα-Cβ链的氧化断裂形成苯甲酸;(2)β-芳醚键和侧链结构的改变:(3)芳香环通过氧化开环发生降解。白腐菌对木质素的降解是以自由基为基础的链反应过程[58]。首先,在有氧条件下,H2O2激活过氧化物酶,过氧化物酶触发生成许多高度反应性的自由基活性中间体,然后以链反应的方式继续产生多种自由基,导致各种连接键的断裂,使木质素解聚成各种低分子量片段,其中小于lKD的占多数,再彻底的氧化成为CO2[59]。这种自由基反应是高度非特异性和无立体选择性的,即白腐真菌与被降解底物并非酶与底物的一一对应关系,而是与一类乃至多类底物的关系[60]。3木质素降解酶的活性调控11
影响木质素降解酶产生的外界因素主要有:碳源、氮源、诱导剂和表面活性剂、微量元素等。C和N这两种重要的营养调控着真菌木质素降解酶的合成和活性。C源和N源的种类以及C/N比是影响木质素降解酶含量的主要因素。因此,近年来已成为被广泛研究的热点[61-63]。诱导物不仅能诱导木质素降解酶的产生,还起到分散剂和保护剂的作用,研究较多的是藜芦醇(VA)。表面活性剂主要是提高细胞膜的渗透性,菌种不同,最适的表面活性剂也不同,研究最多的是吐温80。同时,关于其他诱导剂和表面活性剂的研究也有很多[64,65]。已有研究表明在培养体系中加入苯甲醇,可以显著提高木质素酶的活性[61]。一般而言,重金属对酶主要起抑制作用。然而最新研究发现,重金属如Zn和Cu在低浓度下能够提高真菌的LiP和MnP活性,而Mn和Cu更是分别直接参与了MnP和Lac的催化循环,是木质素降解酶所需的主要微量元素。因此,重金属对木质素降解酶的诱导作用受到普遍关注[66,67]。培养温度、氧浓度、通气状况、pH值、代谢产物乃至环境湿度等,也是影响木质素降解酶产生的因素。培养温度和pH值对Lac的影响因具体菌种而异,不同的菌种有不同的适宜培养温度和pH值。4结语利用微生物降解木质素是一个复杂的生物化学作用过程,不同酶活性的高低还可能与它们在木质素降解中的作用大小和不同降解阶段中的作用顺序有关。其中,酶系组成和生物化学反应机制尚有许多未知数,因此仍需对其催化机制和木质素降解酶基因表达调控机制等进行综合研究。目前,生物降解多采用混合发酵[68-74],由于菌种彼此间木质素降解酶系、生活史长短、营养需求及生长因子等不同的生物学特性互补,在分泌木质素降解酶系上表现了较好的种属互惠性,使混合发酵降解率以及酶活显著高于单一菌种,达到高降解的目的。因此,采用分子生物学方法构建具有木质素降解基因的工程菌[75-78],以及筛选出更加高效降解木质素的复合菌系均是未来的发展方向。相信在不久的将来,随着对木质素酶催化机理认识的加深,以及应用分子生物学技术对木质素降解酶相关基因结构、表达调控机理等深入研究,木质素的生物降解将取得重大突破;同时,随着科学技术的发展和研究的不断深入,开发出高效降解木质素的复合菌剂,对于解决能源紧张、粮食短缺及环境污染等难题也同样具有重要的指导作用。 参考文献[1]蒋挺大.木质素(第二版)[M].北京:化学工业出版社,2008,1–16.[2]ZhangGM(张桂梅),LiaoSQ(廖双泉),LinHL(蔺海兰),etal.Progressinstudyingtheextractionandcomprehensiveutilizationoflignin[J].ChineseJournalofTropicalAgriculture(热带农业科学),2005,25(1):66–70.[3]杨长军,汪勤,张光岳.木质纤维素原料预处理技术研究进展[J].酿酒科技,2008(3):85-89.[4]DashtbanM,SchraftH,SyedTA.Fungalbiodegradationandenzymaticmodificationoflignin[J].IntJBiochemMolBiol,2010,1(1):36–50.[5]彭晓光,杨林娥,张磊.生物法降解秸秆木质素研究进展[J].现代农业科技,2010(1):18-20.[6]XuCY,MaF,ZhangXY,etal.BiologicalpretreatmentofcornstoverbyIrpexlacteusforenzymatic11
hydrolysis[J].JAgricFoodChem,2010,58(20):10893-10898.[7]刘庆玉,陈志丽,张敏.木质素降解菌的筛选[J].太阳能学报,2010,31(2):269-272.[8]JiangL(江凌),WuHZ(吴海珍),WeiCH(韦朝海),etal.Researchprogressofcharacterizationofwhite-rotfungusenzymesystemforlignindegradationanditsapplication[J].ChemicalIndustryandEngineeringProgress(化工进展),2007,26(2):198-202.[9]ZengGM,HuangDL,HuangGH,etal.Compostingoflead-contaminatedsolidwastewithinoculaofwhite-rotfungus[J].BioresourTechnol,2007,98(2):320-326.[10]许云贺,张莉力,王凤娥.白腐真菌研究进展[J].畜牧兽医科技信息,2007(12):11–12.[11]KerstenP,CullenD.Extracellularoxidativesystemsofthelignin-degradingBasidiomycetePhanerochaetechrysosporium[J].ForestGenetBiol,2007,44(2):77–87.[12]SanchezC.Lignocellulosicresidues:biodegradationandbioconversionbyfungi.BiotechnolAdv,2009,27(2):185–194.[13]Márquez-AraqueAT,MartínezGDM,DavidG.FibrolyticactivityofenzymesproducedbyTrametessp.EUM1,PleurotusostreatusIE8andAspergillusnigerAD96.4insolidfermentation[J].INCI,2007,32(11):780–785.[14]CabukA,UnalAT,KolankayaN.Biodegradationofcyanidebyawhiterotfungus,Trametesversicolor[J].BiotechnolLett,2006,28(16):1313–1317.[15]TongPG,HongYZ,XiaoYZ,etal.Highproductionoflaccasebyanewbasidiomycete,Trametessp[J].BiotechnolLett,2007,29(2):295–301.[16]MacarenaS,FernandoLL,MónicaV.IncompleteprocessingofperoxidasetranscriptsinthelignindegradingfungusPhanerochaetechrysosporium[J].FEMSMicrobiolLett,2005,242(1):37–44.[17]ÜrekRÖ,PazarlioǧluNK.ProductionandstimulationofmanganeseperoxidasebyimmobilizedPhanerechaetechrysosporium[J].ProcessBiochem,2005,40(1):83–87.[18]胡琪,邓斐,吴学玲.木质素的微生物降解[J].科技信息,2008(10):12–13.[19]KumarL,RathoreVS,SrivastavaHS.(14)C-[lignin]-lignocellulosebiodegradationbybacteriaisolated frompollutedsoil[J].IndianJExpBiol,2001,39(6):584–589.[20]TuomelaM,VikmanbM,HatakkaA.Biodegradationoflignininacompostenvironment[J].BioresourTechnol,2000,72(2):169–183.[21]张甲耀,龚利萍,罗宇煊.嗜碱细菌复合碳源条件下对麦草木质素的降解[J].环境科学,2002,23(1):70–73.11
[22]Mikan-VenegasJF,Castellanos-SuarezDE.Screeningforisolationandcharacterisationofmicroorganismsandenzymeswithusefulpotentialfordegradationofcelluloseandhemicellulose[J].RevColombBiotechnol,2004,6(1):58–67.[23]BenimeliaCS,CastroaGR,ChailecAP.LindaneuptakeanddegradationbyaquaticStreptomycessp.strainM7[J].IntBiodeterBiodegr,2007,59(2):148–155.[24]ZhangJP(张金萍),WangJW(王敬文),JiangJM(姜景民),etal.Comparisononlignin-degradingenzymesofganoderma-lucidumfungi[J].ForestResearch(林业科学研究),2005,18(1):106–108.[25]Bonugli-SantosRC,DurrantLR,DaSilvaM.Productionoflaccase,manganeseperoxidaseandligninperoxidasebyBrazilianmarine-derivedfungi[J].EnzymeMicrobTechnol,2010,46(1):32–37.[26]YuHY,ZengGM,HuangGH,etal.LignindegradationbyPenicilliumsimplicissimum[J].EnvironSci,2005,26(2):167–171.[27]ZmitrovichIV,PsurtsevaNV.Evolutionaryandtaxonomicalaspectsofsearchandstudyoflignin-degradingfungi-activeproducersofoxidativeenzymes[J].MikologiiaiFitopatologiia,2007,41(1):57–58.[28]张力,邵喜霞,韩大勇.白腐真菌木质素降解酶系研究进展[J].畜牧与饲料科学,2009,30(2):9–10.[29]BaborováP,MöderM,BaldrianP.Purificationofanewmanganeseperoxidaseofthewhite-rotfungusIrpexlacteusanddegradationofpolycyclicaromatichydrocarbonsbytheenzyme[J].ResMicrobiol,2006,157(3):248–253.[30]AsgherM,BhattiHN,AshrafM.Recentdevelopmentsinbiodegradationofindustrialpollutantsbywhiterotfungiandtheirenzymesystem[J].Biodeg,2008,19(6):771–783.[31]ŠušlaM,SvobodováK.Effectofvarioussyntheticdyesontheproductionofmanganese-dependentperoxidaseisoenzymesbyimmobilizedIrpexlacteus[J].WorldJMicrobiolBiotechnol,2008,24(2):225–230.[32]LeandroP,MariaJM.ProductionandcharacterizationoflaccaseandmanganeseperoxidasefromtheligninolyticfungusFomessclerodermeus[J].JChemTechnolBiotechnol,2006,81(6):1064–1070.[33]ChengXB,JiaR,LiPS,etal.Purificationofanewmanganeseperoxidaseofthewhite-rotfungusSchizophyllumsp.F17,anddecolorizationofazodyesbytheenzyme[J].EnzymeMicrobTechnol,2007,41(3):258–264.[34]ItohH,WadaM,HondaY,etal.Bioorganosolvepretreatmentsforsimultaneoussaccharificationandfermentationofbeechwoodbyethanolysisandwhiterotfungi[J].JBiotechnol,2003,103(3):273–280.[35]HofrichterM.Review:ligninconversionbymanganeseperxidases(MnP)[J].EnzymeMicrobTechnol,2002,30(4):454–466.11
[36]AsgherM,ShahSAH,AliM,etal.DecolorizationofsomereactivetextiledyesbywhiterotfungiisolatedinPakistan[J].WorldJMicrobiolBiotechnol,2006,22(1):89–93.[37]HiraiH,SugiuraM,KawaiS,etal.Characteristicsofanovelligninperoxidasesproducedbywhite-rotfungusPhanerochaetesordidaYK-624[J].FEMSMicrobiolLett,2005,246(1):19–24.[38]AsgherM,KausarS,BhattiHN,etal.OptimizationofmediumfordecolorizationofSolargoldenyellowRdirecttextiledyebySchizophyllumcommuneIBL-06[J].IntBiodeterBiodegr,2008,61(2):189–193.[39]HammelKE,CullenD.Roleoffungalperoxidasesinbiologicalligninolysis[J].CurrOpinPlantBiol,2008,11(5):349–355.[40]FerrazA,GuerraA,MendonaR,etal.Technologicaladvancesandmechanisticbasisforfungalbiopulping[J].EnzymeMicrobTechnol,2007,43(2):178–185.[41]刘海进,李吕木.木质素过氧化物酶的研究迸展[J].中国饲料,2010(2):20–21.[42]LiangS(梁帅),ZhouDM(周德明),FengYR(冯友仁).ResearchprogressandapplicationprospectofLaccasefromwhiterotfungus[J].AnhuiAgriSci(安徽农业科学),2008,36(4):1317–1319.[43]Zouari-MechichiH,MechichiT,DhouibA,etal.LaccasepurificationandcharacterizationfromTrametestrogiiisolatedinTunisia:decolorizationoftextiledyesbythepurifiedenzyme[J].EnzymeMicrobTechnol,2006,39(1):141–148.[44]QuaratinoD,FedericiF,PetruccioliM,etal.Production,purificationandpartialcharacterisationofanovellaccasefromthewhite-rotfungusPanustigrinusCBS577.79[J].AntonieVanLeeuwenhoekIntJGenetMolMicrobiol,2007,91(1):57–69.[45]HildenK,HakalaTK,LundellT.Thermotolerantandthermostablelaccases[J].BiotechnolLett,2009,31(8):1117–1128.[46]ChangA,ScheerM,GroteA.BRENDA,AMENDAandFRENDAtheenzymeinformationsystem:newcontentandtoolsin2009[J].NucleicAcidsRes,2009,37(1):588–592.[47]GarzilloAM,ColaoMC,BuonocoreV,etal.StructuralandkineticcharacterizationofnativelaccasesfromPleurotusostreatus,RigidoporuslignosusandTrametestrogii[J].JProtChem,2001,20(3):191–201.[48]DedeyanB,KlonowskaA,TaggerS,etal.BiochemicalandmolecularcharacterizationofalaccasefromMarasmiumquarcophilus[J].ApplEnvironMicrobiol,2000,66(3):925–929.[49]李志兰,孟浩.木质素的生物合成及降解研究现状[J].浙江农业科学,2010(4):914–917.[50]李玉英,杨震宇.漆酶的特性和应用研究进展[J].江西科学,2009,27(5):681–682.[51]SinghD,ChenSL.Thewhite-rotfungusPhanerochaetechrysosporium:conditionsfortheproductionof11
lignin-degradingenzymes[J].ApplMicrobiolBiotechnol,2008,81(3):399–417.[52]RosalesE,RodriguezCoutoS,SanromaMA.IncreasedlaccaseproductionbyTrameteshirsutagrownongroundorangepeelings[J].EnzymeMicrobTechnol,2007,40(5):1286–1290.[53]OsmaJF,SaraviaV,HerreraJLT,etal.Mandarinpeelings:ThebestcarbonsourcetoproducelaccasebystaticculturesofTrametespubescens[J].Chemosphere,2007,67:1677–1680.[54]LevinL,HerrmannC,PapinuttiVL.Optimizationoflignocellulolyticenzymeproductionbythewhite-rotfungusTrametestrogiiinsolid-statefermentationusingresponsesurfacemethodology[J].BiochemEngJ,2008,39(1):207–214.[55]ElisashviliV,KachlishviliE,TsiklauriN.Lignocellulose-degradingenzymeproductionbywhite-rotBasidiomycetesisolatedfromtheforestsofGeorgia[J].WorldJMicrobiolBiotechnol,2009,25(2):331–339.[56]YangXW,MaF,ZengYL,etal.Structurealterationofligninincornstoverdegradedbywhite-rotfungusIrpexlacteusCD2[J].IntBiodeterBiodegr,2010,64(2):119–123.[57]闰鑫鹏,李杰.白腐真菌在农作物秸秆中的研究与应用[J].饲料工业,2008,29(14):54–57.[58]张辉.木质素降解酶系研究新进展[J].天津农业科学,2006,12(3):8–12.[59]李春凤,王力生.白腐真菌降解木质素酶系特性及其应用[J].现代农业科技,2009(11):274–275.[60]HiguchiT.Microbialdegradationoflignin:Roleofligninperoxidase,manganeseperoxidase,andlaccase[J].ProcJpnAcadB,2004,80(5):204–214.[61]李翠珍,文湘华.白腐真菌F2的生长及产木质素降解酶特性的研究[J].环境科学学报,2005,25(2):226–231.[62]张晓昱,杜甫佑,王宏勋.不同木质纤维素基质上白腐菌降解特性的研究[J].微生物学杂志,2004,24(6):4–7.[63]范寰,梁军锋,赵润,等.不同碳氮源对复合木质素降解菌木质素降解酶系活力的影响[J].农业环境科学学报,2010,29(7):1394–1398.[64]段传人,贾秋云.白腐菌混合菌降解木质素最佳条件的优化[J].生物技术通报,2009,(12):167–171.[65]MaríaCT,TaniaG,JoséMC.Structuralclose-relatedaromaticcompoundshavedifferenteffectsonlaccaseactivityandonlccgeneexpressonintheligninolyticfungusTrametessp.I-62[J].FungalGenetBiol,2004,41:954–962.[66]JacobC,CourbotM,MartinF,etal.TranscriptomicresponsestocadmiumintheectomycorrhizalfungusPaxillusinvolutus[J].FEBSLett,2004,576(3):423–427.[67]方华,黄俊,陈瞾,等.白腐菌分泌漆酶的培养条件研究[J].化学与生物工程,2008,25(8):30–33.11
[68]ChiYJ,HatakkaA,MaijalaP.Canco-culturingoftwowhite-rotfungiincreaselignindegradationandtheproductionoflignin-degradingenzymes[J].IntBiodeterBiodegr,2007,59(1):32–39.[69]ZhangHS,LiangJF,ZhangKQ,etal.Effectsoftwospeciesofpleurotusonchemicalcompositionandrumendigestibilityofwheatstraw[J].JAgroEnvironSci,2009,28(10):2185–2188.[70]段传人,朱丽平,姚月良.三种白腐菌及其组合菌种木质素降解酶比较研究[J].菌物学报,2009,28(4):577–583.[71]陈耀宁,曾光明,喻曼.与黄孢原毛平革菌协同降解稻草的混合菌筛选[J].中国环境科学,2007,27(2):189–193.[72]蒋荣清,袁兴中,曾光明.一组高效木质素降解复合菌的筛选[J].应用与环境生物学报,2010,16(2):247–251.[73]黄茜,黄凤洪,江木兰.木质素降解菌的筛选及混合菌发酵降解秸秆的研究[J].中国生物工程杂志,2008,28(2):66–70.[74]范寰,梁军锋,赵润.复合木质素降解菌对麦秸降解及相关酶活的研究[J].饲料研究,2010(6):1-4.[75]喻云梅,刘赟,翁恩琪,等.白腐真菌木质素降解酶的产生及其调控机制研究进展[J].安全与环境学报,2005,5(2):82–86.[76]董亮,谢冰,黄民生,等.白腐真菌酶学与分子生物学研究进展[J].环境科学与技术,2005,28(5):102–104.[77]周宏敏,洪宇植,肖亚.栓菌漆酶在毕赤酵母中高效表达及重组酶的性质[J].生物工程学报,2007,23(6):1052–1059.[78]HuangST,TzeanSS,TsaiBY.Cloningandheterologousexpressionofanovelligninolyticperoxidasegenefromporoidbrown-rotfungusAntrodiacinnamomea[J].Microbiol,2009,155(2):424–433.11