- 1.12 MB
- 19页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
Æ溶酶体膜的稳定性溶酶体的外被是一层单位膜,内部没有任何特殊的结构。由于溶酶体中含有各种不同的水解酶类,所以溶酶体在生活细胞中必须是高度稳定的。溶酶体的稳定性与其膜的结构组成有关:Ä溶酶体膜中嵌有质子运输泵(H+-ATPase),将H+泵入溶酶体内,使溶酶体中的H+浓度比细胞质中高;同时,在溶酶体膜上有Cl-离子通道蛋白,可向溶酶体中运输Cl-离子,两种运输蛋白作用的结果,就等于向溶酶体中运输了HCl,以此维持溶酶体内部的酸性环境(pH约为4.6~4.8)。Ä溶酶体膜含有各种不同酸性的、高度糖基化膜整合蛋白,这些膜整合蛋白的功能可能是保护溶酶体的膜免遭溶酶体内酶的攻击,有利于防止自身膜蛋白的降解。Ä溶酶体膜含有较高的胆固醇,促进了膜结构的稳定。9.4.2溶酶体的发现与溶酶体的酶类溶酶体内含有50多种酶类,这些酶的最适pH值是5.0,故均为酸性水解酶(acidhydrolases)。图9-37是典型的溶酶体的大小、所含主要酶类及膜中的V-型质子泵等。酸性磷酸酶是溶酶体的标志酶,正是对这种酶的细胞定位研究导致溶酶体的发现。图9-37溶酶体的形态、大小、及所含主要酶类示意图Æ酸性磷酸酶的定位研究与溶酶体的发现在二十世纪的五十年代初期,ChristiandeDuve和他的同事在研究亚细胞组分时发现了溶酶体,不过,溶酶体的发现带有很大的偶然性。你了解溶酶体的发现过程吗?Æ溶酶体的酶溶酶体的酶都有一个共同的特点∶都是水解酶类,在酸性pH58
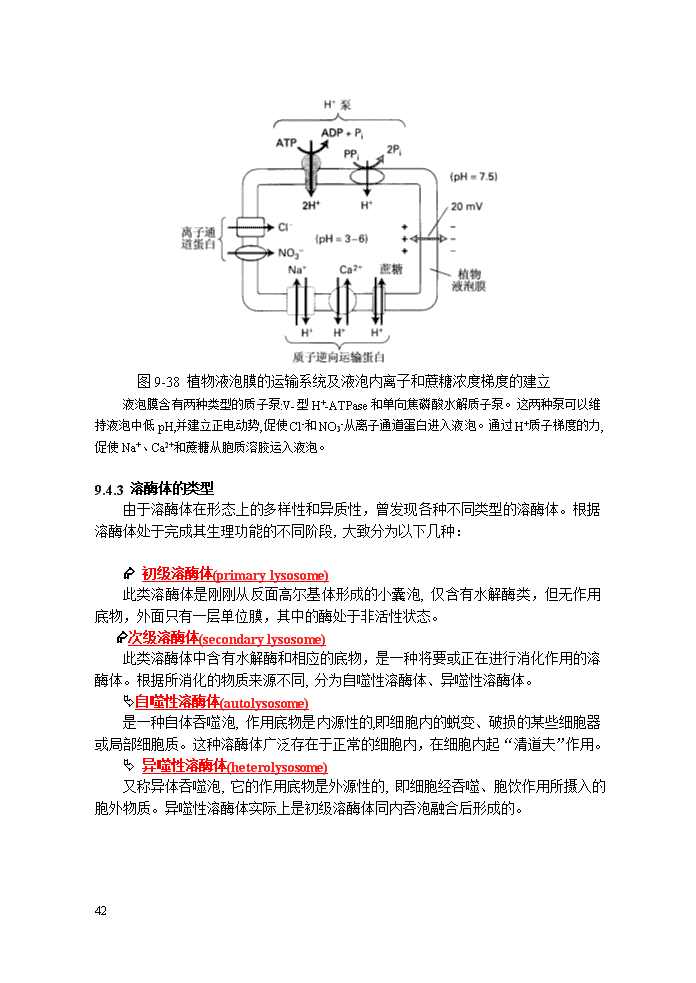
条件下具有最高的活性。溶酶体的酶包括∶蛋白酶、核酸酶、脂酶、糖苷酶等,主要类型的酶列于表9-8。表9-8溶酶体的主要酶类酶天然底物酶天然底物磷酸酶类酸性磷酸酶磷酸单脂酸性磷酸二脂酶磷酸二脂酸性焦磷酸酶ATP,FAD磷脂酸磷酸酶磷脂酸磷酸蛋白磷酸酶磷酸蛋白硫酸酯酶芳基硫酸酯酶芳基硫酸酯蛋白酶和肽酶组织蛋白酶蛋白质胶原酶胶原肽酶肽核酸酶核糖核酸酶RNA脱氧核糖核酸酶DNA脂酶磷酸脂酶磷脂酯酶脂肪酸酯β-葡萄糖脑苷脂酶葡萄糖脑苷脂糖苷酶α葡萄糖苷酶糖原β葡萄糖苷酶糖蛋白β-半乳糖苷酶糖脂、糖蛋白溶菌酶细菌的细胞壁Æ植物溶酶体Ä圆球体(spherosome)是植物细胞中由一层单位膜包裹的含有细微结构的球形颗粒,直径为0.5~1μm,内含酸性水解酶,相当于动物细胞的溶酶体。Ä植物细胞的液泡(vacuoles)植物细胞的液泡几乎占据了细胞总体积的90%,它含有多种水解酶类,并具有与动物细胞的溶酶体酶的类似的功能。液泡膜上具有H+-ATPase,能够将H+运输到液泡中,同时在液泡膜上还有一些运输蛋白,帮助液泡行使一些特殊的功能(图9-38)。58
图9-38植物液泡膜的运输系统及液泡内离子和蔗糖浓度梯度的建立液泡膜含有两种类型的质子泵:V-型H+-ATPase和单向焦磷酸水解质子泵。这两种泵可以维持液泡中低pH,并建立正电动势,促使Cl-和NO3-从离子通道蛋白进入液泡。通过H+质子梯度的力,促使Na+、Ca2+和蔗糖从胞质溶胶运入液泡。9.4.3溶酶体的类型由于溶酶体在形态上的多样性和异质性,曾发现各种不同类型的溶酶体。根据溶酶体处于完成其生理功能的不同阶段,大致分为以下几种:Æ初级溶酶体(primarylysosome)此类溶酶体是刚刚从反面高尔基体形成的小囊泡,仅含有水解酶类,但无作用底物,外面只有一层单位膜,其中的酶处于非活性状态。Æ次级溶酶体(secondarylysosome)此类溶酶体中含有水解酶和相应的底物,是一种将要或正在进行消化作用的溶酶体。根据所消化的物质来源不同,分为自噬性溶酶体、异噬性溶酶体。Ä自噬性溶酶体(autolysosome)是一种自体吞噬泡,作用底物是内源性的,即细胞内的蜕变、破损的某些细胞器或局部细胞质。这种溶酶体广泛存在于正常的细胞内,在细胞内起“清道夫”作用。Ä异噬性溶酶体(heterolysosome)又称异体吞噬泡,它的作用底物是外源性的,即细胞经吞噬、胞饮作用所摄入的胞外物质。异噬性溶酶体实际上是初级溶酶体同内吞泡融合后形成的。58
9.4.4溶酶体的功能溶酶体的主要功能是消化作用(图9-39)。其消化底物的来源有三种途径:①自体吞噬(autophagy),吞噬的是细胞内原有的物质;②通过吞噬形成的吞噬体(phagosome)提供的有害物质;③通过内吞作用(endocytosis)提供的营养物质。由于吞噬作用和内吞作用提供的被消化的物质都是来自细胞外,又将这两种来源的物质消化作用统称为异体吞噬(heterophagy)。图9-39溶酶体的类型及在细胞消化过程中的作用图中简示了溶酶体的四种消化作用:A.吞噬作用;B自噬作用;C.自溶作用;D.细胞外消化作用。Æ吞噬作用(phagocytosis)Ä吞噬作用外来的有害物质被吞入细胞后,即形成由膜包裹的吞噬小体(phagosome),初级溶酶体很快同吞噬体融合形成次级溶酶体,此时溶酶体中的底物是从细胞外摄取的,故为异噬性的溶酶体,在异噬性的溶酶体中吞噬物被酶水解(图9-40)。58
图9-40吞噬作用吞噬作用的第一阶段是细胞质膜上的受体与细菌结合,然后将被感染的细菌包裹起来形成吞噬体,接着是溶酶体与吞噬体融合,通过溶酶体酶的作用将被吞噬的细菌降解。Ä吞噬细胞多细胞的动物具有专门的吞噬细胞,即巨噬细胞(macrophages)和中性粒细胞(neutrophils)担任机体中的保护防御任务。吞噬作用也是细胞获取营养的一种方式,细胞通过内吞作用将一些营养物质包进内吞体,最后与溶酶体融合,在溶酶体酶的作用下,将吞进的营养物质消化形成可直接利用的小分子用于合成代谢。吞噬作用也包括对衰老的、进入编程死亡的细胞的吞噬。Æ自噬作用(autophagy)Ä自噬作用自噬作用主要是清除降解细胞内受损伤的细胞结构、衰老的细胞器、以及不再需要的生物大分子等(图9-41)。58
图9-41自噬作用电镜照片所示是衰老的线粒体和过氧化物酶体被包裹在一个双层膜结构中,该膜来自于内质网。被ER膜包裹而成的自噬体将会与溶酶体融合,进而被溶酶体酶降解。Ä自噬作用的意义自噬作用对细胞的生命活动有什么意义?Ä吞噬过程被吞噬的细胞器和生物大分子先要被内质网的膜包裹起来形成自噬泡(autophagicvacuole,图9-42),然后与初级溶酶体融合形成次级溶酶体,即自噬性的溶酶体,融合后的底物被溶酶体酶消化。58
图9-42自体吞噬泡形成的机制内质网形成一个双膜的杯形结构(a,b),衰老的细胞器(线粒体)从杯口进入(c),然后封口(d),形成双膜的小泡。小泡与成熟的溶酶体融合(e),或与来自溶酶体分泌小泡融合(f),溶酶体的酶降解融合泡中的底物(g)。Æ自溶作用(autolysis)自溶作用是细胞的自我毁灭(cellularself-destruction),即溶酶体将酶释放出来将自身细胞降解。在正常情况下,溶酶体的膜是十分稳定的,不会对细胞自身造成伤害。如果细胞受到严重损伤,造成溶酶体破裂,那么细胞就会在溶酶体酶的作用下被降解,如某些红细胞常会有这种情况发生。在多细胞生物的发育过程中,自溶对于形态建成具有重要作用。58
Æ细胞外的消化作用(extracellulardigestion)溶酶体除了在细胞内具有消化作用外,也可以将水解酶释放到细胞外消化细胞外物质。如精子头部的顶端质膜下方有一膜包裹的囊状结构,称为顶体(acrosome),是一种特殊的溶酶体,在受精过程中,通过顶体反应,将顶体中的溶酶体的酶释放到细胞外(图9-43),消化卵外膜滤泡细胞,使精子抵达卵子质膜,卵子和精子的细胞质膜相互融合,达到受精的目的。图9-43顶体反应(a)海胆精子前端的顶体,正好位于细胞核的前面;(b)当精子的质膜与卵细胞周围物质接触时,精子释放出顶体中溶酶体的酶,消化卵细胞外的物质,使精子得以与卵细胞接触。9.4.5溶酶体的生物发生溶酶体的形成是一个相当复杂的过程,涉及的细胞器有内质网、高尔基体和内体等。比较清楚的是甘露糖-6-磷酸途径(mannose6-phosphatesortingpathway):溶酶体的酶类在内质网上起始合成,跨膜进入内质网的腔,在顺面高尔基体带上甘露糖6-磷酸标记后在高尔基体反面网络形成溶酶体分泌小泡,最后还要通过脱磷酸才成为成熟的溶酶体(图9-44)。58
图9-44溶酶体的酶寻靶过程、涉及的细胞器及机理大多数溶酶体的酶在寡糖链上含有甘露糖,在顺面高尔基网络转变成甘露糖-6-磷酸。新形成的溶酶体的酶通过高尔基复合体,在高尔基体反面网络与膜受体结合后被包进溶酶体分泌小泡,通过出芽形成自由的分泌泡。通过H+-质子泵调节溶酶体分泌小泡中的pH,使溶酶体的酶同受体脱离,受体再循环,溶酶体酶脱磷酸后成为成熟的初级溶酶体。Æ溶酶体酶蛋白的M6P标记研究发现,溶酶体的酶上都有一个特殊的标记∶6-磷酸甘露糖(mannose6-phosphate,M6P)。这一标记是溶酶体酶合成后在粗面内质网和高尔基体通过糖基化和磷酸化添加上去的。Ä糖基化溶酶体酶蛋白在膜旁核糖体上合成,进入内质网后进行N-连接糖基化,经加工后形成带有8个甘露糖残基和2个N-乙酰葡萄糖胺残基的糖蛋白转运到高尔基体。58
Ä信号斑(signalpatch)信号斑是溶酶体酶蛋白多肽形成的一个特殊的三维结构,它是由三段信号序列构成的,可被磷酸转移酶特异性识别(图9-45)。图9-45信号斑溶酶体蛋白的多肽上有三段信号序列,通过折叠,三个信号序列相互靠近形成信号斑结构。Ä甘露糖磷酸化的酶将磷酸基团添加到溶酶体酶的甘露糖的第六位碳上的反应是由两种酶催化的,一种酶是N-乙酰葡萄糖胺磷酸转移酶(N-acetyglucosaminephosphotransferase),另一个酶是N-乙酰葡萄糖苷酶,功能是释放N-乙酰葡萄糖胺(46)。图9-46溶酶体酶蛋白信号斑与磷酸化酶相互作用顺面高尔基体中的N-乙酰葡萄糖胺磷酸转移酶有两个功能位点,一个识别位点能够识别信号斑并与之结合;催化位点与高甘露糖N-连接的寡聚糖以及UDP-GlcNAc结合。Ä磷酸化反应反应中磷酸基的供体是UDPN-乙酰葡萄糖胺(N-acetyglucosamine,GlcNAc),甘露糖残基磷酸化的位点是第六位碳原子(图9-47)。每个溶酶体酶蛋白至少有一个甘露糖残基被磷酸化。溶酶体酶蛋白M6P标记是怎样形成的?58
图9-47溶酶体酶蛋白甘露糖残基磷酸化的生化反应Æ溶酶体酶的M6P分选途径这一途径的两个关键是:M6P标记和M6P受体蛋白。ÄM6P受体蛋白(M6Preceptorprotein)M6P受体蛋白是反面高尔基网络上的膜整合蛋白,能够识别溶酶体水解酶上的M6P信号并与之结合,从而将溶酶体的酶蛋白分选出来。M6P受体蛋白主要存在于高尔基体的反面网络,但在一些动物细胞的质膜中发现有很多M6P受体蛋白的存在,这是细胞的一种保护机制,可防止溶酶体的酶不正确地分泌到细胞外。Ä分选过程图9-48综合了溶酶体酶的甘露糖6-磷酸分选途径和溶酶体形成的主要过程。58
图9-48甘露糖6-磷酸分选途径和溶酶体形成的主要过程溶酶体酶前体从粗面内质网转移到顺面高尔基体,并进行甘露糖残基的磷酸化。在反面高尔基网络,磷酸化的酶同M6P受体结合,通过该受体将溶酶体的酶包装到由纤维状网格蛋白包被的小泡中,然后网格蛋白外被很快解体。无包被的运输小泡很快与次级内体融合,由于次级内体中pH呈酸性,致使磷酸化的酶与M6P受体脱离,接着脱磷酸。通过次级内体的分选作用.溶酶体的酶进入从次级内体出芽形成的运输小泡,接着同溶酶体融合完成溶酶体酶的传递过程。而受体重新回到高尔基体再利用。为简化起见,图中只标出酶蛋白的一个糖基化位点,实际上大多数糖蛋白具有多个糖基化的位点。M6P受体也位于细胞质膜中,它能够同偶尔分泌到细胞外磷酸化的溶酶体酶结合,并形成由网格蛋白包被的运输泡,最后同样被传递给溶酶体。溶酶体的酶是如何经M6P分选途径进行分选的?Ä影响M6P分选的因素Brown和Farquhar发现用胺离子(NH4+)处理细胞能够干扰溶酶体的分选机制。当溶酶体中胺离子浓度升高时会使溶酶体中的pH升高,这样,溶酶体的酶就不能同M6P受体脱离,从而影响了M6P受体回到高尔基体再循环。其结果,由于高尔基体反面网络中M6P受体的不足,溶酶体的酶就会分泌到细胞外而不是被包装到溶酶体分泌小泡。如果解除NH4+的作用,使M6P受体得以释放和再循环,溶酶体的分选恢复正常。58
ÄM6P分选途径的特点:①M6P作为分选信号;②包埋在高尔基体中的受体能够被网格蛋白包装成分泌小泡;③出芽形成的溶酶体酶的运输小泡只同酸性的次级内体融合;④通过次级内体的分选作用使受体再循环。ÆM6P分选途径的发现M6P分选途径是通过对一类遗传病:称为溶酶体贮积症(lysosomalstoragediseases)的研究发现的,此类遗传病是由于溶酶体中缺少一种或几种酶所致。如何根据溶酶体贮积症研究M6P分选途径?Æ内体(endosome)内体有初级内体(earlyendosome)和次级内体(lateendosome)之分,内体的主要特征是酸性的、不含溶酶体酶的小囊泡。初级内体是由于细胞的内吞作用而形成的含有内吞物质的膜结合的细胞器。次级内体中的pH呈酸性,且具有分拣作用。内体膜上具有ATPase-H+质子泵,利用H+质子的浓度,保证了内部pH的酸性(图9-49)。图9-49溶酶体酶运输小泡与次级内体的融合及次级内体的分选作用Æ溶酶体形成的非M6P途径M6P途径是溶酶体酶分选的主要途径,但不是惟一的途径,这主要是通过对一种遗传病的研究发现的。Ä粘脂病(mucolipidosis)是一种遗传病,这种病人不能使甘露糖磷酸化。病人的成纤维细胞中含有很多细胞质小泡,小泡中有大量的未被消化的大分子,这些大分子在正常情况下是由溶酶体降解的。由于甘露糖不被磷酸化,意味着大多数溶酶体酶不能正确地进入溶酶体。58
Ä非磷酸化的溶酶体酶在粘脂病的病人细胞的溶酶体中发现有未被磷酸化的水解酶,推测这些酶是通过非M6P依赖性的分选途径进入溶酶体的。这种推测从I-细胞病人的肝细胞溶酶体酶分析中得到证实。I-细胞病人的肝细胞中溶酶体的酶也没有M6P标记,但是能够进入溶酶体,这就说明这些溶酶体必然是通过非M6P依赖的途径进入溶酶体的,但机理尚不清楚。Ä非M6P途径的可能方式两种可能:一是作为膜蛋白,合成时就插在膜上;另一种可能就是作为前体合成并结合在膜上,进入溶酶体膜后水解释放到溶酶体腔中。请举例说明溶酶体酶进入溶酶体的非M6P途径的可能方式。Æ溶酶体与疾病已知有不少疾病与溶酶体有关,如贮积症(storagediseases)、I-细胞病、矽肺、类风湿性关节炎等。Ä矽肺病(silicosis)ÄⅡ型糖原贮积症(glycogenstoragediseasetypeⅡ)Ä休克(shock)9.5细胞的分泌与内吞作用将蛋白质运送给细胞质膜或细胞外是通过细胞的胞吐作用(exocytosis),也称细胞的分泌活动。与分泌过程相反的是细胞的内吞作用。9.5.1细胞分泌(cellsecretion)动物细胞和植物细胞将在粗面内质网上合成而又非内质网组成部分的蛋白和脂通过小泡运输的方式经过高尔基体的进一步加工和分选运送到细胞内相应结构、细胞质膜以及细胞外的过程称为细胞的分泌。Æ细胞分泌活动的过程细胞分泌活动是非常重要的生命现象,整个过程涉及三种不同的细胞器和细胞结构(图9-50)∶内质网、高尔基体、细胞质膜。这三部分相当于三道关卡,严格地控制着产品的质量。这三个部分的职能又是不同的,内质网相当于生产基地,高尔基体相当于产品的精加工和质量检测分配部门,而细胞质膜相当于海关。58
图9-50细胞的分泌与内吞作用图中显示了由ER合成的蛋白质经分泌小泡通过高尔基体复合物运向各目的地,包括溶酶体。分泌泡分泌途径:①核糖体合成的蛋白质与粗面内质网外表面的结合,并在ER腔中糖基化;②从内质网形成的小泡携带新合成并经糖基化的蛋白到达顺面高尔基体;③通过膜融合,蛋白质进入高尔基体,并在高尔基体中进一步加工后通过小泡转运到反面高尔基体,经浓缩并经出芽形成④分泌小泡或⑤溶酶体小泡;分泌小泡移向质膜,或通过组成型(4a)或通过调节型(4b)释放小泡内容物;⑥内吞作用从细胞外摄取蛋白质或其他物质,内吞泡或是与反面高尔基体融合(6a)或是与溶酶体融合(6b)。Æ组成型和调节型的分泌蛋白质从内质网经高尔基体到细胞表面的物质运输是通过运输小泡和胞吐作用不断进行的。这种分泌活动分为两种类型,组成型和调节型(图9-51)。58
图9-51组成型和调节型分泌活动Ä组成型分泌途径(constitutivesecretorypathway)这种分泌途径中运输小泡持续不断地从高尔基体运送到细胞质膜,并立即进行膜的融合,将分泌小泡中的蛋白质释放到细胞外,此过程不需要任何信号的触发,它存在于所有类型的细胞中。组成型分泌途径除了给细胞外提供酶、生长因子和细胞外基质成分外,也为细胞质膜提供膜整合蛋白和膜脂。组成型分泌小泡通常称为运输泡(transportvesicles),是由高尔基体反面网络对组成型分泌蛋白的识别分选后形成的。Ä调节型分泌途径(regulatedsecretorypathway)又称诱导型,见于某些特化的细胞,如内分泌细胞。调节型分泌小泡通过出芽离开反面高尔基网络并聚集在细胞质膜附近,当细胞受到细胞外信号刺激时,就会与细胞质膜融合将内含物释放到细胞外。如血糖的增加,细胞会发出信号释放胰岛素。调节型途径中形成的小泡称为分泌泡(secretoryvesicles)。调节型分泌有两个特点:一是具有选择性;第二个特点是具有浓缩作用,可使被运输的物质浓度提高200倍。Æ极性细胞中的蛋白质分选运输Ä极性细胞中膜蛋白的选择性分泌在极性细胞中,细胞质膜蛋白的分泌具有选择性,主要是通过反面高尔基网络进行选择性包装,将不同部位膜蛋白包装到不同的小泡,然后运送到不同的部位。或是通过转胞吞作用(transcytosis)(图9-52)。58
图9-52表皮细胞的顶部和基底侧质膜蛋白的分选培养的MDCK表皮细胞同时被VSV和流感病毒感染,VSV糖蛋白(G蛋白)只存在基底侧质膜中,而流感病毒的HA糖蛋白仅在顶部质膜中发现。如同这些病毒蛋白,某些细胞质膜的蛋白在反面高尔基体分选后通过特殊的运输小泡运输到顶部和基底部的细胞质膜。在其他的一些极性细胞中,基底和顶部质膜蛋白先一起运输到基底部,然后通过内吞作用再将顶部质膜蛋白分选出来运输到顶部。极性细胞中的膜蛋白通过什么方式进行选择性运输的?Æ分泌过程中的蛋白质加工Ä对于细胞质膜蛋白和大多数分泌蛋白而言,开始合成的是相当长的没有活性的前体,称为前蛋白(proprotein),这些蛋白需要进一步加工才能成为成熟的、有活性的蛋白质,如血清白蛋白(serumalbumin)、胰岛素、胰高血糖素、酵母的α交配因子以及所有的分泌蛋白和膜蛋白,包括流感病毒的HA蛋白。Ä一般说来,前体蛋白被酶解转变成成熟的分子是在离开高尔基体后的分泌小泡中进行的。正常情况下,成熟的分泌小泡是由几个不成熟的小泡融合而成的,然后通过加工使蛋白质成熟。Ä某些前蛋白质,包括前白蛋白(proalbumin)在C-末端的某一位点切割一次,产生两个碱性的识别序列,如∶Arg-Arg或者Lys-Arg(图9-53a);另外一些前蛋白,在N-端切除几个氨基酸或在N-端和C-端同时切除几个氨基酸。在前胰岛素中,58
多余的氨基酸称为C肽,位于多肽的内部,加工时要将C肽切除,并将两端的A肽和B肽通过二硫键连接起来(图9-53b)才有功能。图9-53前白蛋白和前胰岛素在组成型和调节型分泌过程中的加工在加工过程中由内切蛋白酶切割C-末端,产生两个连接在一起的碱性氨基酸。(a)内切蛋白酶—成对碱性氨基酸蛋白酶(furin)切割组成型分泌蛋白的前体;(b)两个内切蛋白酶PC2和PC3作用于调节型分泌蛋白的前体。多数此类蛋白的最后一步加工是由羧肽酶(carboxypeptidase)切除多肽链C-末端的两个碱性氨基酸。Æ胞吐作用(exocytosis)与膜的融合Ä胞吐作用胞吐作用是指真核细胞中含有待分泌物的包被小泡与质膜融合,从而将内含物排出胞外的过程。在组成型分泌活动中,胞吐作用是自发进行的,但是在调节型的细胞中,胞吐作用必需有信号的触发。胞吐作用的结果一方面将分泌物释放到细胞外,另一方面小泡的膜融入质膜,58
使质膜得以补充。Ä膜的融合在胞吐过程中,分泌泡同细胞质膜的融合只发生在局部细胞质膜上。融合作用是通过融合蛋白(fusionprotein)介导的,这些融合蛋白位于膜的表面和膜内,它们的作用是使两种不同的膜靠近、接触、最后融合。两种膜接触导致小的融合孔(fusionpore)的形成(图9-54),最后两种膜融为一体。图9-54胞吐作用与膜融合模型①两种膜蛋白相互接触;②两种膜之间形成一个封闭的孔,并逐渐扩大;③由于膜脂的扩散,两种膜的脂双层融合成一体。58