- 25.24 KB
- 6页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'北京迈誉森生物科技有限公司工艺标准操作规程文件编号MYS-JS-02-03版本号A/0编制/日期审核/日期批准/日期1目的:建立工艺操作规程的编制和管理规程,明确工艺操作规程编制的内容要求及管理程序,使其规范化、标准化、程序化。2范围:适用于本公司免疫比浊法的体外诊断试剂产品的生产。3职责3.1技术部技术人员负责工艺标准操作规程的编制、评审和修改。3.2技术部经理负责工艺标准操作规程的审核、批准。3.3行政部负责技术文件的发放、保存、归档。3.4发放到各部门的技术文件由各部门保存。内容:1.总则1.1工艺是生产产品的具体方法,是把人、机、料、环四大因素,在特定条件下结合起来,把静态因素变为动态生产过程的手段。工艺方法的先进性、可行性、严肃性和相对稳定性,是保证产品质量的重要因素。工艺方法用文字、图表或其他载体确定下来,就是工艺文件。1.2工艺操作规程是根据试制过程的技术资料,经过验证,对产品的原辅材料、生产过程、规格标准、包装设计、质量控制等进行全面描述,用以指导和规范产品制造的基准性标准文件,为计划、组织和控制生产,制定生产指令、包装指令、批记录提供依据,也是企业各部门共同遵循的准则。2.工艺操作规程的编制依据和基本要求2.1应符合本公司文件系统管理规程的基本要求。2.2编制工艺操作规程必须以法定标准及行业标准(即体外诊断试剂)和对产品批准的注册文件(批文)为依据。由生产部试制和工艺验证结束后,会同质量部、物流部、生产部编写和编制过程中要科学地总结试制生产和验证的经验与数据,采取先进的技术,确保产品优质,指标先进,生产安全。2.3各种工艺技术参数和技术经济定额之度、量、衡单位均按国家规定,采取法定计量单位。2.4成品名称以法定通用名为准。2.5原材料名称一律采用法定名,适当附注商品名或其他通用别名。6
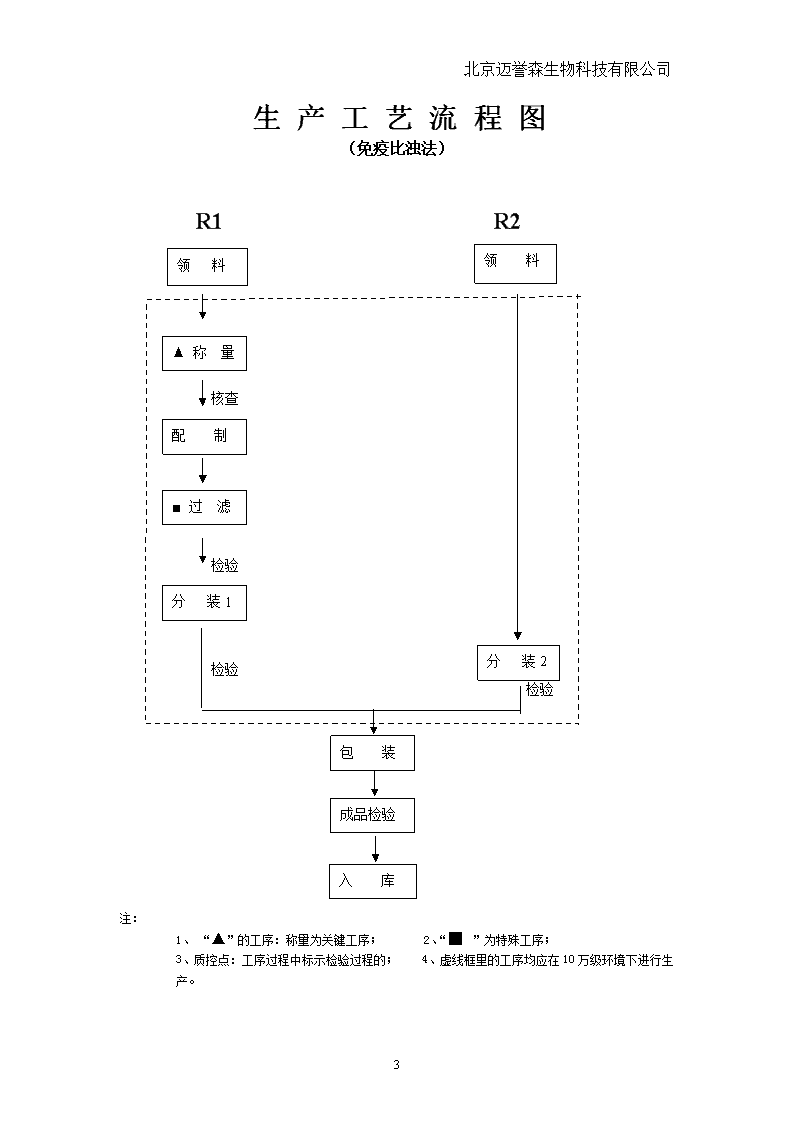
北京迈誉森生物科技有限公司2.6成品、中间体、原料分子量一律以最新国际原子量表计算,取两位小数。3.工艺操作规程的主要内容及说明3.1产品名称:3.2产品概述3.2.1性状:按产品标准编写。3.2.2作用用途:按产品标准编写。2.2.3用法用量:按产品标准编写。3.2.4规格:按产品标准编写。3.2.5注意事项:3.2.6有效期:按产品标准编写。3.4工艺流程图从原料到制成品全过程,按工序注明主要工艺技术条件的示意图。6
北京迈誉森生物科技有限公司生产工艺流程图(免疫比浊法)R1R2领料领料▲称量核查配制■过滤检验分装1分装2检验检验包装成品检验入库注:1、“▲”的工序:称量为关键工序;2、“■”为特殊工序;3、质控点:工序过程中标示检验过程的;4、虚线框里的工序均应在10万级环境下进行生产。6
北京迈誉森生物科技有限公司3.5原材料:3.6工艺操作及工艺条件按工艺流程详细阐明每道工序操作过程并写明按处方量的投料批量、工艺技术标准、物料平衡、环境条件、使用的设备、容器技术经济指标(其中包括各步半成品收率、贮存过程及有关的工艺条件)。要求参数明确、术语规范、语言精炼。3.7原辅料规格(等级)、质量标准。3.7.1原料:试剂中的主要成分,对产品性能起关键作用的物料。3.7.2辅料:除原料之外,产品中的一切附加物料和参与生产过程的各种物料统称辅料。3.7.3按生产的需要和实际技术水平,规定原辅料的质量检查方法。3.7.4半成品的质量标准和检查方法半成品:是试剂生产过程中,按工序已改变其物理性状或化学性质的阶段性产物。在编制其标准时,应按顺序写明主要半成品的质量标准的检查方法,或标明引用标准文件的编号。3.8成品的质量标准和检查方法成品是指一个产品已完成了全部生产过程,经检验符合规定的质量标准并可供销售的产品。其质量标准和检查方法需严格按法定标准逐项编写,或标明引用标准文件的编号。3.9内控质量标准:指高于法定标准的产品出厂放行标准。3.10包装材料和包装规格、质量标准包括内外、大小包装、说明书、标签。包装可按小包装到大包装顺序说明。3.11工艺卫生要求是指为了保证试剂质量,对生产厂房、设备、容器、工具、操作人员卫生方面提出的要求和必须采取的措施,可注明所采用的工艺卫生文件编号。3.12技术安全及劳动保护系在生产过程中,为了保护操作人员和国家财产,防止和消除公伤事故所采取的技术措施。如防火、防爆、防毒、防腐蚀及安全用电、安全用气等技术措施。主要指生产过程中为保护职工的健康,采取的各种安全技术措施。如噪音、粉尘的消除,有害气体的防护,防署、降温、防冻等技术措施。在编写时,也应简要说明有关防护设施的性能和使用要求。简要说明工艺中所采用的安全设施的性能,劳动保护和使用维护方法,或列上其依据的文件。3.13劳动组织、岗位定员、工时定额与产品生产周期3.13.1劳动组织、岗位定员与工时定额A)劳动组织:内容包括生产该产品所需设置的车间、班组和生产班次。B)岗位定员:系指按生产岗位编制定员数。C)工序工时定额:系指生产单位产品该工序所耗用的劳动时间。工序工时定额=工序劳动时间/单位合格品产品产量D)产品工时定额:为各工序工时定额之和。6
北京迈誉森生物科技有限公司3.13.2工序生产周期和产品生产周期A)工序生产周期:系指生产一定数量的产品(一般为安排一次生产的最低投产量),该工序从投料到制成品出厂经过的全部日历时间。生产周期丐产品的工序、设备等因素有关,也与产品在工序间的移动方式有关。在这里,生产周期的制订,主要指生产每个工序的制成品在工艺过程中所需的日历时间,其中也包括半成品按工艺规定需要的贮存时间。B)产品生产周期:为各工序生产周期之和减去在生产过程中前后工序生产周期重叠的日历时间。3.14包装材料消耗定额:包装材料消耗额=包装材料消耗量/包装产品数量4.工艺操作规程的管理4.1产品工艺改革及新产品试产期,应编制暂行工艺操作规程,待完成验证、生产正常后,编制正式规程。4.2工艺操作规程的管理程序应符合厂内的《文件系统管理规程》要求。4.2.1每个产品的工艺操作规程的编写和修订,由生产部根据试制工艺、工艺验证的过程、结果,同时按文件系统管理规程的基本要求起草或修订,并编写“文件编订说明”同时申请编号。4.2.2工艺操作规程编率(或修订)的初稿,连同编(修)订申请说明一并交给质量部组织会审。4.2.3会审后文件初稿及会审意见返回生产部,由生产部对工艺操作规程初稿进行修改定稿(如需再次会审,仍执行会审程序),经质量部负责人审查后签字。然后,连同编订说明及会审意见,报总经理审核,审核无误后,签字批准,签署生效日期,准予颁布。4.3工艺操作规程的印制、颁布与回收程序要符合《文件系统管理规程》要求。4.3.1对批准印制的工艺操作规程,由生产部根据该工艺操作规程涉及到的相关部门和生产车间工艺员根据复制计划在本工厂内复制。定复制计划,包括文件的分发单位、数量、及质量要求等内容。印制数量的原则是:总经理、技术部、生产部、质量部、行政部存档各1份,共印制5份。4.3.2该复制计划报总经理批准后,交给行政部,由行政部管理。4.3.3复制后的工艺操作规程经核对无误,由起草人、审核人、批准人签字后,加盖企业公章即可生效。4.3.4工艺操作规程属保密技术文件,任何部门必须按密级文件保管,不得私自复印。4.3.5工艺操作规程的颁发程序必须符合《文件系统管理规程》有关规定。4.3.6工艺操作规程修订并被批准使用后,原工艺操作规程自新工艺操作规程生效之日起废止,新规程生效后15日内及时收回原有工艺操作规程。4.3.7工艺操作规程发现错误,使生产车间操作失误,影响产品质量时,必须立即废止,并6
北京迈誉森生物科技有限公司及时回收,同时填写文件回收登记表。4.4工艺操作规程的归档与销毁工作必须符合《文件系统管理规程》有关规定。4.5各级工艺技术管理人员要经常检查工艺操作规程的执行情况,依据工艺纪律考核和奖惩办法,对模范执行者给予表扬和奖励。对违反工艺操作规程的操作,应立即制止,并对违反者按规定处理,对造成事故者,要追究责任,视情节的轻重给予必要的处分。6'