- 443.42 KB
- 7页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
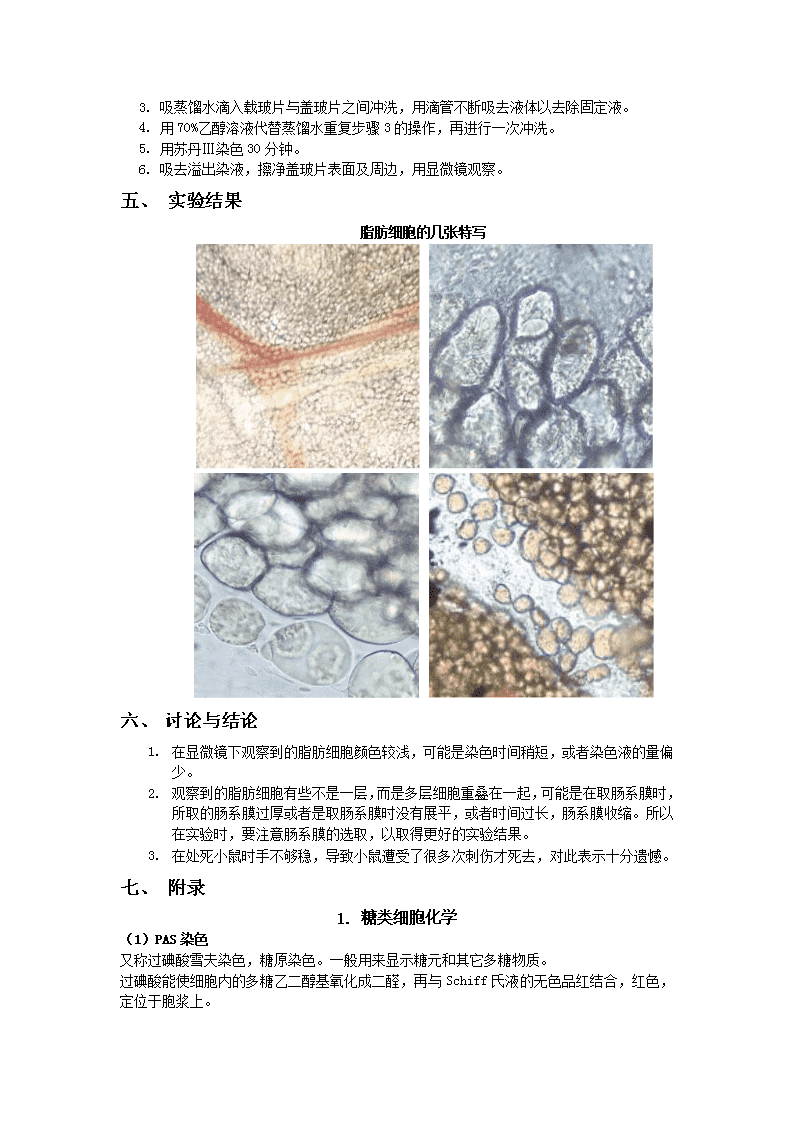
实验二脂类细胞化学——苏丹Ⅲ染色法13生物基地201300140059刘洋2015-03-16同组者:吕赞孙佳孟何娟一、实验目的1.了解脂肪染色的原理以及脂类标本制片的原理。2.学习用苏丹Ⅲ染色脂肪细胞的方法。3.学习用断头法处死小白鼠以及小白鼠的解剖方法。二、实验原理脂类包括的范围很广,有单纯脂、复合脂、衍生脂等。脂肪是体内储存能量和供给能量的重要物质,根据其性质可以分为中性脂肪、脂肪酸、胆固醇、鞘磷脂等。很多细胞都含有脂肪,游离状态的脂肪呈小滴状悬浮于细胞质内,比较显著的如肝细胞。脂肪小滴可以集合,将细胞质及细胞核挤到一旁,如脂肪细胞。脂肪不溶于水,易溶于浓乙醇、苯、氯仿和乙醚等,因此制作脂类标本一般不用石蜡切片,而用冰冻切片或者铺片法以保存脂类,固定多用甲醛类固定液。其染色方法有脂溶性染料显示法、化学显示法和特异染色法等。脂溶性染料显示法利用苏丹染料中的苏丹III、苏丹IV、苏丹黑或者苏丹红等溶于脂类,苏丹染料是偶氮染料,它对脂类的显示是一种简单的物理变化。使用时,要注意选择溶剂,要求既要溶解苏丹染料,又不溶掉脂肪。苏丹染料是一种脂溶性染料,易溶于乙醇但更易溶于脂肪,所以当含有脂肪的标本与苏丹染料接触时,苏丹染料即脱离乙醇而溶于该含脂肪结构中而使其显色。用锇酸固定的脂肪不溶于无水乙醇、二甲苯等类似的液体,可用于石蜡切片,但是脂肪的标本一般不用石蜡切片或火棉胶包埋,而用如下方法:(1)冰冻切片;(2)明胶包埋冰冻切片;(3)铺片法。三、实验材料和用品1.材料小鼠肠系膜。2.试剂苏丹Ⅲ染液,70%乙醇溶液,甲醛钙。3.器材显微镜,载玻片,盖玻片,胶头滴管,镊子,剪刀,解剖盘。四、实验步骤1.断头法处死小白鼠,置于解剖盘中,剪开腹腔,用镊子提起小肠将盖玻片紧贴于肠系膜,在肠系膜的另一侧盖一盖玻片,将肠系膜连同小肠一同剪下。2.滴加甲醛钙于有标本的载玻片处,使标本润湿,固定20分钟。
1.吸蒸馏水滴入载玻片与盖玻片之间冲洗,用滴管不断吸去液体以去除固定液。2.用70%乙醇溶液代替蒸馏水重复步骤3的操作,再进行一次冲洗。3.用苏丹Ⅲ染色30分钟。4.吸去溢出染液,擦净盖玻片表面及周边,用显微镜观察。一、实验结果脂肪细胞的几张特写二、讨论与结论1.在显微镜下观察到的脂肪细胞颜色较浅,可能是染色时间稍短,或者染色液的量偏少。2.观察到的脂肪细胞有些不是一层,而是多层细胞重叠在一起,可能是在取肠系膜时,所取的肠系膜过厚或者是取肠系膜时没有展平,或者时间过长,肠系膜收缩。所以在实验时,要注意肠系膜的选取,以取得更好的实验结果。3.在处死小鼠时手不够稳,导致小鼠遭受了很多次刺伤才死去,对此表示十分遗憾。三、附录1.糖类细胞化学(1)PAS染色又称过碘酸雪夫染色,糖原染色。一般用来显示糖元和其它多糖物质。过碘酸能使细胞内的多糖乙二醇基氧化成二醛,再与Schiff氏液的无色品红结合,红色,定位于胞浆上。
应用:随着医学实验技术的发展,糖原染色应用的范围更加广泛,如用以证明与鉴别细胞内空泡状的性质,心肌病变及其他心血管疾病的诊断,糖原累积病诊断和研究,糖尿病的诊断和研究,用于某些肿瘤的诊断等。除用于糖原的鉴定和黏液的显示外,还可以观察肾小球基底膜、结肠杯状细胞中性黏液物质、阿米巴滋养体和霉菌的着色。临床诊断、分类和治疗提供了重要的依据。试剂:Carnoy固定液:纯酒精60ml 冰醋酸10ml氯仿30ml,也可以选用75%酒精.1)过碘酸酒精夜配法:过碘酸(HIO.2HO)0.4g 95%酒精35ml M/5醋酸钠(2.72g+蒸馏水100ml)5ml蒸馏水10ml保存于冰箱内,用棕色瓶,可用两周.2)Schiff氏液:0.5克碱性品红加入100毫升蒸馏水中,时时摇动三角瓶5分钟,使之充分溶解.冷却至50℃后过滤加入10毫升1N盐酸.冷却至25℃,加入0.5-1克偏重硫酸钠,在室温中至少静置24小时,然后密封冰箱保存.3)Schiff氏酒精液配置 Schiff氏液11.5ml 1NHCI0.5ml 纯酒精23ml4)亚硫酸水1%偏重亚硫酸钠10ml 1NHCI10ml 蒸馏水180ml的树胶溶解。5)哈瑞或迈耶苏木精略染色步骤:1)石蜡切片脱蜡至水(细胞涂片,冰冻切片直接水洗)2)蒸馏水洗3)过碘酸酒清夜10min4)自来水冲洗10min5)Schiff氏液10min6)流水冲洗5min7)用哈瑞苏木精或迈耶苏木精染核3min(细胞核染色过深可用盐酸酒精分化)8)流水冲洗5min9)常规脱水、透明、封固结果:阳性反应,胞浆呈红色,阴性反应,胞浆呈无色;在正常血片中RBC不染色;PLT染成深红色;中性粒细胞胞浆染成红色或深红色,有些细胞有阳性颗粒;单核细胞的胞浆染成淡红色,可含有细小或粗大阳性颗粒;少数淋巴细胞的胞浆内含有少许小的淡红色或红色颗粒;正常骨髓的幼稚细胞和有核RBC都不染色;巨核细胞的胞浆内呈弥散红色或深红色。巨核细胞的胞浆内呈弥散红色或深红色。(2)阿新蓝-PAS法显示酸性、中性黏多糖阿新蓝属于阳离子染料,是显示酸性黏液物质最特异的染料,染料与酸性基团形成盐键。利用染料的不同pH及不同电解质浓度,可区分酸性黏液物质的类别。1.核酸细胞化学
(1)Feulgen反应法DNA是主要的遗传物质,集中于染色体上。1924年孚尔根首先用席夫试剂(Schiff)作试验,鉴定了染色体上DNA的存在,故称为孚尔根染色法。孚尔根染色法的反应原理主要与席夫试剂的化学性质有关,此试剂的基本成分是碱性品红,偏亚硫酸氢钠(NaHSO3)和盐酸.碱性品红的主要成分是三氨基三苯甲烷氯化物。碱性品红原为桃红色,当与亚硫酸作用时还原,使醌型变为苯型,由桃红色变为无色透明的N-亚磺酸亚硫酸副品红碱,当它与醛基作用时,其分子式又恢复为醌型结构,呈现紫红色,其反应式见图。利用1NHCl、60℃下水解时,可将DNA分子中嘌呤碱基与去氧核糖之间的糖苷键打断,使嘌呤脱下,并使去氧核糖C-1位置释放醛基与席夫试剂反应显紫红色。细胞中只有DNA才具有这种专一的孚尔根反应,因此利用孚尔根反应,可以鉴定DNA的存在。并广泛应用于核及染色体的研究中。(2)甲基绿-派洛宁法甲基绿,派洛宁为两种碱性染料,与带负电荷的磷酸根形成盐键。甲基绿分子有两个正电荷,是具有金属光泽的绿色微结晶或亮绿色粉末。溶于水,显蓝绿色。稍溶于乙醇,不溶于戊醇。盐酸中显红黄色,在氢氧化钠中无色。试剂溶液在可见光区有吸收峰。甲基绿—为碱性染料,它分别能与细胞内的DNA、RNA结合呈现不同颜色。甲基绿易与双链DNA分子结合,使DNA显示绿色。派洛宁为碱性染料,有一个正电荷,易与单链RNA结合使RNA显示红色。所以派洛宁与核仁、细胞质中的RNA选择性结合显示红色。也有人认为染色原理与核酸分子的空间构型有关。
(3)Giemsa染色法Giemsa染液由天青,伊红组成。染色原理和结果与瑞特染色法基本相同。嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结果,染粉红色,称为嗜酸性物质;细胞核蛋白和淋巴细胞胞浆为酸性,与碱性染料美蓝或天青结合,染紫蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和美蓝均可结合,染淡紫色,称为中性物质。PH对细胞染色有影响。细胞各种成分均不蛋白质,由于蛋白质系两性电解质,所带电荷随溶液PH而定,在偏酸性环境中下在电荷增多,易与伊红结合,染色偏红;在偏三性环境中负电荷增多,易与美蓝或天青结合,染色偏蓝。因此细胞染色对氢离子浓度十分敏感,染色用正经片必须清洁,无酸碱污染。配制顼特液必须用优质甲醇,稀释染色必须用缓冲液,冲洗用水应近中性,否则可导致各种细胞染色反应异常,以致识别困难,甚至造成错误。Giemsa染色也是最常用的染色方法之一,适用于多种细胞和染色体染色。其主要用Giemsa染液可将细胞核染成紫红色或蓝紫色,胞浆染成粉红色,在光镜下呈现出清晰的细胞及染色体图像。试剂:Giemsa粉0.5g,甘油22mL,将Giemsa粉置于研钵内先用少量甘油与之充分混合,研磨至无颗粒;然后将剩余的甘油混在一起,56℃保温2小时后,加入33mL纯甲醇,保存于棕色瓶内。染色步骤:1)准备染液:用pH6.81~7.38的Sorensen缓冲液,按1:9比例取Giemsa染液和Sorensen缓冲液混合配成染色液;Sorensen缓冲液的配制:pH6.81:Na2HPO4(1/15M)50mL+KH2PO4(1/15M)50mL;pH6.98:Na2HPO4(1/15M)60mL+KH2PO4(1/15M)40mLpH7.17:Na2HPO4(1/15M)70mL+KH2PO4(1/15M)30mL;pH7.38:Na2HPO4(1/15M)80mL+KH2PO4(1/15M)20mL。2)细胞标本用甲醇固定10分钟,或用1:3醋酸/甲醇固定30分钟,用滴管把染色液布满玻片上,注意不要有气泡,用染色缸染色亦可,染10~15分钟;3)用自来水冲去玻片上多余的染料,自然干燥,二甲苯透明,光学树脂胶封固。染色液宜现用现配,保存时间不超过48小时。缓冲液pH值要准确,否则影响染色效果。用染色缸染色前应先用小片滤纸刮除液面的氧化后,再进行染色。染色完毕将标本浸入水中洗除染液。结果:Giemsa染色光镜下观察细胞核呈紫红色或蓝紫色,细胞浆成粉红色。(4)苏木精-伊红(HE)染色去氧核糖核酸(DNA)两条链上的磷酸基向外,带负电荷,呈酸性,很容易与带正电荷的苏木精碱性染料以离子键结合而被染色。苏木精在碱性溶液中称蓝色,所以细胞核被染成蓝色。伊红Y是一种化学合成的酸性染料,在水中离解成带负电荷的阴离子,与蛋白质的氨基正电荷的阳离子结合使胞浆染色,细胞浆、红细胞、肌肉、结缔组织、嗜伊红颗粒等被染成不同程度的红色或粉红色,与蓝色的细胞核形成鲜明对比.伊红是细胞浆的良好染料。一般染色组织切片厚度为3µm左右,中枢神经系统6~8µm,肾小球基底膜染色观察时要求1.5~2µm标准厚度。染色步骤:1)切片在二甲苯中脱蜡5~10分钟。
2)移入二甲苯和纯酒精(1∶1)混合液中5分钟左右(如经二次二甲苯脱蜡,此步可略)。3)入100%、95%、85%、70%酒精,各级为2~5分钟。最后经蒸馏水转入染液。4)苏木精染液染色5~15分钟。5)水洗玻片上多余染液,0.5~1%盐酸酒精(70%酒精配制)分色片刻。镜检控制,直至细胞核及核内染色质清晰为止,约数10秒钟。6)流水冲洗15~30分钟,或者在碳酸锂饱和液中短时间碱化或蓝化,即细胞核呈蓝色。7)蒸馏水短洗。8)0.1~0.5%伊红染液染色1~5分钟,若着色困难,可在每100毫升染液中加入1~2滴冰醋酸,使易着色且不易脱色。9)依次经70%、85%、95%、100%酒精脱水,各级为2~3分钟,在95%以下浓度的酒精中伊红易脱色,应适当缩短时间。10)二甲苯透明(二次),共约10分钟。11)封片:擦去切片周围多余二甲苯,切勿干涸,迅速滴加适量中性树胶,再加盖玻片封固。3.蛋白质细胞化学(1)碱性蛋白与酸性蛋白显示蛋白质的基本组成单位是氨基酸,它们同时具有氨基和羧基(在溶液中主要以—NH3+,—COO—式存在),而自由氨基和羧基的游离取决于溶液的pH值,当蛋白质处于酸性溶液时,由于该溶液中正离(OH—)多,从而抑制蛋白质中的COOH电离,于是造成蛋白质带正电荷多;当蛋白质处于碱性溶液时,由于该溶液中负离子(OH—)多,从而促使蛋白质中的COOH都电离成COO—,于是造成蛋白质带负电荷多;当蛋白质处于某一种pH溶液时,它恰好带有相等的正负电荷(呈兼性离子)。此时的pH值称为等电点(pL),由于蛋白质除了末端氨基和末端羧基之外,还具有许多侧链,其上的许多基团在溶液中也都可以电离,因此,一个蛋白质分子表面四周都有电荷。不同蛋白质分子所带有的碱性基团和酸性基团的数量不等,故它们的等电点也不一样。因此蛋白质分子所带的净电荷取决于:(1)分子中碱性基团和酸性基团含量。(2)所处溶液的pH值,如在生理条件下,整个蛋白质带负电荷多。为酸性蛋白质(等电点偏向酸性);带正电荷多,为碱性蛋白质(等电点偏向碱性)。据此,可将标本经三氯醋酸处理后,用不同pH的固绿染液(一种弱酸性染料,本身带负电荷),予以染色,可使细胞内的酸性蛋白和碱性蛋白分别显示。(2)酸性或碱性磷酸酶显示碱性磷酸酶染色(NAP)中性粒细胞胞质中的碱性磷酸酶在pH9.6的碱性条件下能水解磷酸萘酚,生成萘酚,后者与重氮盐偶联形成不溶性的有色沉淀定位于胞质中的酶活性处。重氮盐有多种,常用的有坚牢蓝RR、坚牢蓝BB、坚牢酱紫等。酸性磷酸酶显示酸性磷酸酶主要位于溶酶体内,是溶酶体的标志酶,而具有吞噬作用的细胞(如单核细胞、巨噬细胞、中性粒细胞)中溶酶体含量最多,在吞噬过程中溶酶体起着十分重要的作用。Gomori氏法显示酸性磷酸酶的原理:细胞中的酸性磷酸酶分解底物(β-甘油磷酸钠)而释放出磷酸基,在pH5.0的环境中,磷酸基与硝酸铅反应,形成磷酸铅。但因其是无色的,所以再经过与硫化铵的作用,形成棕黑色的硫化铅沉淀。由此而显示酸性磷酸酶在细胞内的存在和分布。
(3)过氧化物酶显示(色素形成法)细胞内的过氧化物酶可以将联苯胺氧化成蓝色或者棕色产物,蓝色为中间产物联苯胺蓝,很不稳定,可自然转变为棕色的联苯胺腙,通过产物颜色间接显示出细胞内过氧化物酶的分布。(4)酶联仪测定琥珀酸脱氢酶(MTT法)噻唑兰,简称MTT,可透过细胞膜进入细胞内,活细胞线粒体中的琥珀脱氢酶能使外源性MTT还原为难溶于水的蓝紫色的Formazan结晶并沉积在细胞中,而死细胞没有这种功能。结晶物能被二甲基亚砜(DMSO)溶解,溶液颜色深浅与所含的formazan量成正比。用酶联免疫检测仪在490nm波长处测定其光吸收值,可间接反映细胞数量。