- 718.00 KB
- 35页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
第三章水溶液中的离子平衡
微粒的种类和来源微粒的相互作用相互作用的结果
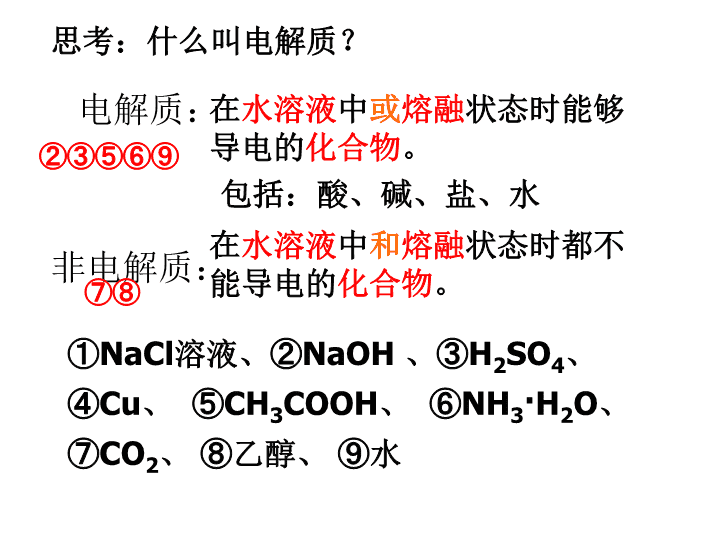
电解质:非电解质:在水溶液中或熔融状态时能够导电的化合物。在水溶液中和熔融状态时都不能导电的化合物。①NaCl溶液、②NaOH、③H2SO4、④Cu、⑤CH3COOH、⑥NH3·H2O、⑦CO2、⑧乙醇、⑨水②③⑤⑥⑨⑦⑧思考:什么叫电解质?包括:酸、碱、盐、水
清洁厕所常用盐酸,
为什么不用较安全的醋酸?因为盐酸的去污能力比醋酸强。
实验探究:分别试验等体积、等浓度的盐酸、醋酸与等量镁条的反应。观察现象,并解释说明。实验要点:盐酸和醋酸浓度均为1mol/L;镁条用砂纸打磨、长度相同(表面积相同);
与镁条反应的现象1mol/LCH3COOH1mol/LHCl对实验现象的解释镁与等浓度的盐酸、醋酸反应的速率,前者快于后者。镁与盐酸反应非常剧烈,产生大量的气泡。等浓度的盐酸中c(H+)比醋酸大.镁与醋酸反应较快,产生气泡。
盐酸中存在H+、Cl-无HCl分子醋酸溶液中存在H+、CH3COO-和CH3COOH分子分析:
结论:盐酸完全电离,电离程度大,醋酸不完全电离,电离程度较小,
强电解质:包括:强酸、强碱、大多数盐、活泼金属氧化物包括:弱酸(如CH3COOH)、弱碱(如NH3·H2O)、水HCl=H++Cl–能全部电离的电解质称强电解质.部分电离的电解质称弱电解质.弱电解质:概念一、强弱电解质
微粒的种类和来源微粒的相互作用相互作用的结果弱电解质的电离
二、弱电解质的电离平衡思考与讨论:(2)当V电离=V结合时,可逆过程达到一种什么样的状态?CH3COOHCH3COO-+H+电离结合(1)开始时,V电离和V结合怎样变化?
电离平衡状态建立反应速率V(电离)V(结合)V(电离)=V(结合)电离平衡状态弱电解质电离平衡状态建立示意图时间
1.电离平衡:在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态书P41电离平衡和化学平衡一样,当外界条件改变时符合勒夏特列原理。
思考与交流(见课本P41)1.写出弱酸、弱碱的电离方程式;2.填写下表的空白:C(H+)C(A-)C(HA)HA初溶于水时达到电离平衡前达到电离平衡时C(B+)C(OH-)C(BOH)等体积等浓度的B+、OH-溶液相混合时达到电离平衡前不变不变不变达到电离平衡时最小最小最大变大变大变小不变不变不变最大最大最小变小变小变大
2.电离平衡特点:动:电离平衡是一种动态平衡定:条件不变,溶液里既有离子又有分子,且各分子、离子的浓度不变。变:条件改变时,电离平衡发生移动。等:V电离=V结合≠0逆:弱电解质的电离是可逆的
3.影响电离平衡的因素(1)内因:电解质本身的性质。通常电解质越弱,电离程度越小。(2)外因:①温度电离过程是吸热过程,温度升高平衡向电离方向移动。②浓度浓度越小,电离程度越大。平衡向电离方向移动。
思考与讨论:在醋酸溶液中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、CH3COONa溶液、水、加热对平衡有什么影响?加入物质盐酸NaOH溶液醋酸钠溶液水加热平衡移动方向逆正逆正正CH3COOHCH3COO-+H+
——水的离子积常数(水的离子积)K电离.c(H2O)=c(H+).c(OH-)KW=c(H+).c(OH-)电离平衡常数:K电离=c(H+)×c(OH-)c(H2O)三、水的电离:H2OH++OH-电离平衡常数:
分析下表中的数据有何规律,并解释温度0℃20℃25℃50℃100℃Kw0.134×10-140.681×10-141.01×10-145.47×10-1455.0×10-14温度升高,水的离子积增大。水的离子积常数Kw=c(H+).c(OH-)表达式:注:常数无单位结论:
25℃KW=c(H+).c(OH-)=1.0×10-14水的离子积常数思考:25℃纯水中c(H+)?c(OH-)?H2OH++OH-c(H+)=1.0×10-7mol/Lc(OH-)=1.0×10-7mol/L
1)温度:条件对水的电离平衡及Kw的影响KW只与温度有关(与浓度无关),温度升高,KW值增大。如:KW25℃=1.0×10-14KW100℃=1.0×10-12思考:100℃时纯水中的c(H+)?c(OH-)?c(H+)=c(OH-)=1.0×10-6mol/L
2)溶质对水的电离平衡及KW的影响。①加入酸或碱对水的电离有什么影响?促进(正向)还是抑制(逆向)?Kw呢?
讨论:常温下对纯水进行下列操作,完成下表:酸碱性水的电离平衡移动方向C(H+)C(OH-)C(H+)与C(OH-)大小关系Kw变化加热加HCl加NaOH中性→↑↑=↑酸性←↑↓>不变碱性←↓↑<不变结论:酸碱由于电离产生H+或OH-,能抑制水的电离,使水的电离程度减小,但KW不变
#②加入CH3COONa或NH4Cl对水的电离平衡又有什么影响?CH3COO-、NH4+等因能结合水电离出的H+或OH-生成弱的电解质而促进水的电离,使水的电离程度增大,但KW不变#③加入NaCl呢?无影响2)溶质对水的电离平衡及KW的影响。
水的电离过程为H2OH++OH-,在不同温度下其离子积为KW25℃=1.0×10-14,KW35℃=2.1×10-14。则下列叙述正确的是:()A、c(H+)随着温度的升高而降低B、在35℃时,纯水中c(H+)>c(OH-)C、水的电离常数K25℃>K35℃D、水的电离是一个吸热过程D练习1:
练习2:根据水的电离平衡H2OH++OH-和下列条件的改变,填空:升高30℃加入NaCl加入NaAc加入HAcKwC(OH-)变化C(H+)变化水的电离平衡移动方向改变条件←↑↓—→↓↑—————→↑↑↑
请写出Na2SO4、HClO、NH3·H2O、H2CO3、Fe(OH)3在水溶液中的电离方程式。Na2SO4=2Na++SO42-HClOH++ClO-NH3·H2ONH4++OH-H2CO3H++HCO3-HCO3-H++CO32-Fe(OH)3Fe3++3OH-【练习】
注意:强电解质在溶液中完全电离,用“=”弱电解质在溶液中部分电离,用“”多元弱酸的电离应分步完成电离方程式,多元弱碱则一步完成电离方程式。
探究实验:[实验3-2]课本P42你能否推测CH3COOH、H3BO3、H2CO3三种弱酸的相对强弱?结论:CH3COOH>H2CO3>H3BO3
写出H3PO4在水溶液中的电离方程式H3PO4H++H2PO4-H2PO4-H++HPO42-HPO42-H++PO43-你推测每一步的电离程度如何变化,为什么?多元弱酸是分步电离的,K1》K2》K3P43多元弱酸的酸性由第一步电离决定。
试根据课本p43页中“一些弱酸的电离平衡常数”比较它们的相对强弱。草酸>磷酸>柠檬酸>碳酸结论:K值越大,电离程度越大,相应酸(或碱)的酸(或碱)性越强。思考:
填表:0.1mol/L的CH3COOH溶液CH3COOHCH3COO-+H+电离程度n(H+)c(H+)导电能力电离常数加水升温加CH3COONa加HCl加NaOH【练习】增大增大减小减弱不变增大增大增大增强增大减小减小减小增强不变减小增大增大增强不变增大减小减小增强不变